大揭秘!从CNS洞见单细胞蛋白质组学应用

单细胞蛋白质组是一项新兴的技术,正处于蓬勃发展的时期。它可以揭示生命体内功能的真正执行者——蛋白质水平的变化,而引起了众多科研人员的关注。但是也因为这项技术刚刚起步,大家对于如何应用,如何解决科学问题还抱有疑惑。因此,今天小编来跟大家分享一下单细胞蛋白质组学在免疫、干细胞分化、发育三个领域的应用,以期能给大家提供一些思路及灵感。
01
干细胞分化——单细胞组学揭示原发性急性髓系白血病干细胞分化过程
文献名称:Quantitative single-cell proteomics as a tool to characterize cellular hierarchies
发表期刊:Nature Communications(IF 14.919)
样本类型:原发性急性髓系白血病细胞
研究思路:
步骤1:基于单细胞蛋白质组数据对细胞进行分群;
步骤2:比较不同细胞群之间的蛋白质差异,并发现分化的连续性;
步骤3:拟时序分析寻找驱动细胞分化的关键蛋白质。
主要内容:
1. 单细胞蛋白质组学可对不同分化阶段的细胞进行分群
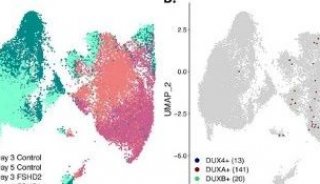
通过流式分选白血病干细胞分化的三个阶段的细胞,进行单细胞蛋白质组分析。基于鉴定到的1790个蛋白质进行降维分析,可以清晰地分离三个已知的分化阶段,再现了FACS分析的结果。

图1-1 细胞分群结果
2. 同一类型细胞间蛋白质表达呈现差异性
将Blasts和其他细胞的蛋白质表达进行比较,从而鉴定到了Blasts和LSC与PROG的差异表达蛋白。有趣的是,这些差异蛋白在同一分化阶段也呈现不一样的表达,表明同一细胞类型的蛋白质表达是有差异的,即细胞分化是个连续性的过程,并且是由一些特定的蛋白质信号驱动的。这是在bulk组学中无法发现的。

图1-2 差异蛋白的表达
3. 单细胞蛋白质组学可进行分化轨迹分析
基于单细胞蛋白质组学的数据进行拟时序分析,结果显示细胞的分化轨迹与FACS数据一致,LSC位于顶点,分化产生了Blasts和PROG。但又发现CD38+和CD38-Blasts细胞沿着轨迹轻微分离,说明可能存在两条平行的分化路径。接下来绘制了沿着伪时间的蛋白质表达谱,揭示了驱动细胞排序的主要因素。
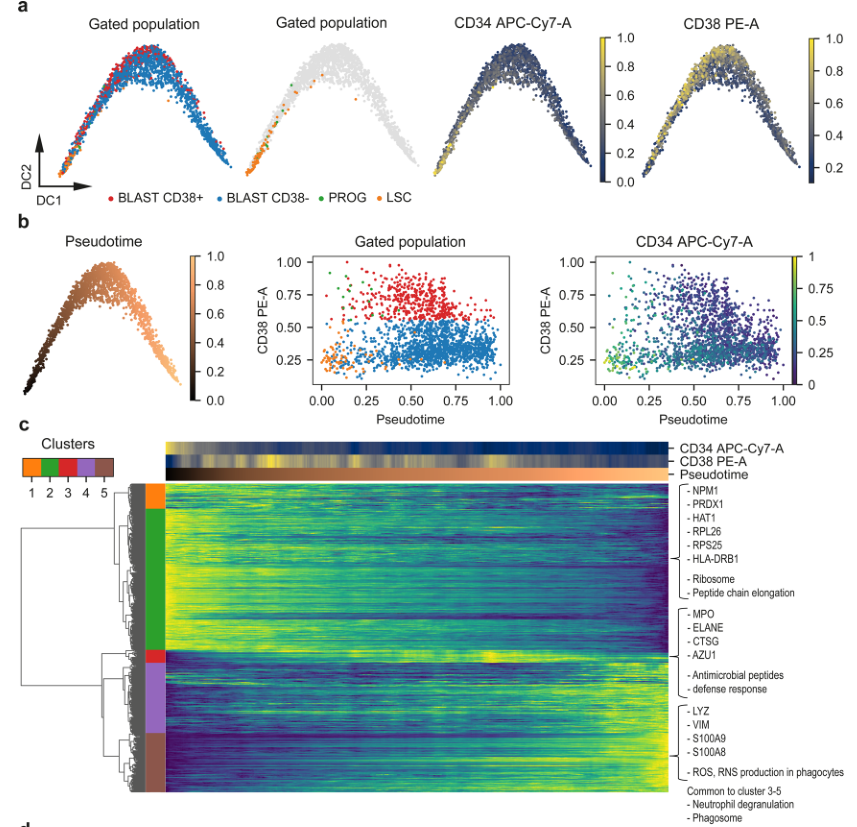
图1-3 拟时序分析
02
免疫——单细胞多组学联合解析巨噬细胞异质性
文献名称:Single-cell proteomic and transcriptomic analysis of macrophage heterogeneity using SCoPE2
发表期刊:Genome Biology(13.583)
研究背景:巨噬细胞是具有不同功能和分子表型的先天免疫细胞,但这种多样性在单细胞蛋白质水平上尚未进行深入研究。
样本类型:PMA激活的单核细胞
研究思路:
步骤1:基于单细胞蛋白质组数据对细胞进行分群;
步骤2:通过分析蛋白质的表达发现巨噬细胞存在异质性;
步骤3:联合单细胞转录组和单细胞蛋白质组的数据比较RNA和蛋白质的共性及差异性。
主要内容:
1. 单细胞蛋白质组学可进行细胞分群
用PMA激活单核细胞的分化后,分选出1490个细胞进行单细胞蛋白质组学分析,总共鉴定到3042个蛋白质。通过PCA分析可将细胞分成两个主要离散的细胞簇,根据细胞特异性表达的蛋白质可将两个细胞簇分别对应于单核细胞和巨噬细胞。与bulk蛋白质组学相比,相关性为0.88,说明单细胞蛋白质组学数据的可靠性。

图2-1 基于单细胞蛋白质组数据进行细胞分群
2. 巨噬细胞间呈现明显的异质性
为了研究同质单核细胞是否会分化为同质巨噬细胞,根据细胞的Fiedler向量值对细胞进行无监督光谱分析,表征细胞异质性。单核细胞中高表达的蛋白质主要与增殖相关,包括染色质组织和翻译;巨噬细胞中富含细胞表面信号传导和细胞粘附相关蛋白,与细胞本身的生物功能一致。对巨噬细胞群体进行分析发现,巨噬细胞的蛋白质表达呈现连续性变化,先前鉴定为M1和M2极化的人原代巨噬细胞特异性表达蛋白质也在巨噬细胞之间差异表达。

图2-2 巨噬细胞极化呈连续性
3. 单细胞水平的转录组和蛋白质组呈现差异性
为了研究RNA和蛋白质水平的相似性和差异,利用来自相同生物学重复的细胞进行单细胞转录组分析,与单细胞蛋白质组进行比较分析。结果发现RNA和蛋白质的相关性呈现双峰分布,即RNA和蛋白质两个水平既具有共变基因(簇1),也具有呈相反的基因(簇2)。同时发现蛋白组的数据更加紧凑,转录组数据更加分散,表明RNA检测中存在更大的生物学和技术变异性。

图2-3 单细胞转录组和单细胞蛋白质组联合分析
03
发育——单细胞组学揭示小鼠性腺发育过程
文献名称:Dissecting Cell Lineage Specification and Sex Fate Determination in Gonadal Somatic Cells Using Single-Cell Transcriptomics
发表期刊:Cell Reports(IF 9.432)
研究背景:卵巢和睾丸具有相同的发育起源,在发育过程中出现两性的区别,而对于在性别决定前性腺细胞谱系知之甚少。
样本类型:Tg(Nr5a1-GFP)转基因小鼠性腺
研究思路:
步骤1:对来自于六个阶段的体细胞进行单细胞转录组分析并进行细胞分群;
步骤2:通过拟时序分析研究雌性体细胞发育过程;
步骤3:比较雌性和雄性的细胞分化过程,证明性别二态性。
主要内容:
1. 体细胞可分为四个细胞群体
从六个不同发育阶段的转基因小鼠性腺中,基于荧光蛋白的表达分选出体细胞进行单细胞转录组检测,总共有563个细胞进行后续分析。根据这563个细胞mRNA的表达,分成了四个细胞簇,基于marker基因及每个簇基因表达的特异性对细胞簇进行定义,分别为早期和基质祖细胞,前颗粒细胞和出生后颗粒细胞。并通过GO分析对四个细胞群体的功能进行注释。

图3-1 早期卵巢发育过程中性腺体细胞的分类
2. 建立雌性体细胞发育谱系
接下来通过扩散图模拟了细胞的分化趋势,建立了细胞发育谱系。结果显示颗粒细胞和基质细胞是从一个共同的祖细胞群分化而来。沿着拟时序对细胞进行排序,绘制随时间的动态表达谱,根据表达模式将基因分类,并进行GO注释,找到关键的驱动分化的基因。

图3-2 早期卵巢发育过程中性腺体细胞的分化
3. 细胞分化呈现性别二态性
建立了雌性性腺的发育图谱后,又将数据与过去的来自雄性性腺的400个体细胞的数据进行了整合,进行降维聚类,以及拟时序分析,证明了从D2细胞起细胞的分化开始出现性别差异,证明了性别二态性。这个文章就是通过单细胞组学进行降维及拟时序分析,研究细胞的分化过程。

图3-3 两种性别的细胞分化过程比较
研究思路总结
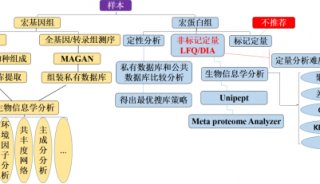
根据以上文献可知,现在的单细胞蛋白质组学技术已经可以实现细胞的分群,细胞功能的注释以及细胞的分化等研究,从蛋白质水平上去解决细胞的异质性的科学问题,推荐的研究思路如下:


中科优品推荐
【中科新生命】单细胞蛋白质组学技术平台拥有可靠的技术路线(已公开发表),独立自主的全流程仪器设备,成熟的单细胞数据分析,为您提供一站式的单细胞研究服务,欢迎感兴趣的老师前来咨询!


<< 滑动查看下一张图片 >>


我知道你
在看
哦