项目文章|SCI ADV (IF:14.957)浙江大学医学院研究代谢产物ADMA介导骨关节炎发展

前言
2023年02月,浙江大学医学院范顺武教授/课题组在 Science Advances期刊发表的题为 “Metabolite asymmetric dimethylarginine (ADMA) functions as a destabilization enhancer of SOX9 mediated by DDAH1 in osteoarthritisx ”(IF:14.957)的研究成果,通过非靶向代谢组学技术、组织学和免疫组织化学、蛋白质免疫印迹技术、蛋白质组学技术、Nano–LC-MS/MS等研究方法,发现了OA软骨细胞特征,探究了OA中ADMA调节的潜在机理,描绘了ADMA参与OA进展图谱,为OA诊断提供了理论依据。

基本信息
中文标题:代谢物不对称二甲基精氨酸作为SOX9的失稳增强剂DDAH1介导骨关节炎
研究对象:人软骨组织
发表期刊:Science Advances
影响因子:14.957
发表时间:2023年2月
合作单位:浙江大学医学院
运用生物技术:非靶向代谢组学技术、组织学和免疫组织化学、蛋白质免疫印迹技术、流式细胞术、蛋白质组学技术、Nano–LC-MS/MS
研究背景
骨关节炎(OA)是一种退行性疾病,主要由老化和机械损伤引起。在OA软骨细胞中,分解代谢调节因子释放多种炎症因子,最终导致细胞外基质(ECM)变性,使OA的发病机制陷入恶性循环。退化的软骨细胞和OA中,下调的二甲基精氨酸二甲基氨基水解酶-1(DDAH1)伴随着不对称二甲基精胺酸(ADMA)的增加。ADMA诱导软骨细胞变性和衰老,并减少ECM沉积,而加速OA发展。研究ADMA在OA中的作用及对OA的影响,探究ADMA调节下游的潜在机制。
研究思路
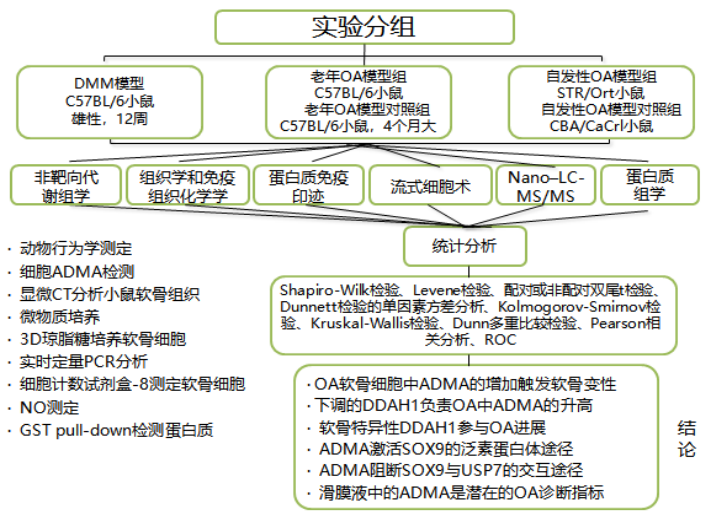
研究方法
1.实验分组
1)DMM模型:C57BL/6小鼠,雄性,12周
2)老年OA模型组:C57BL/6小鼠
3)老年OA模型对照组:C57BL/6小鼠,4个月大
4)自发性OA模型组:OA STR/Ort小鼠
5)自发性OA模型对照组:CBA/CaCrl小鼠
2.技术路线
1)动物行为学测定:热板法、旋转棒法和6分钟距离法
2) LC-MS:细胞ADMA检测
3)显微CT分析:小鼠软骨组织
4)微物质培养:评估ECM沉积
5)3D琼脂糖培养:软骨细胞
6)实时定量PCR分析:QuantStudio 6 Flex实时PCR系统
7)细胞计数试剂盒-8测定:软骨细胞
8)NO测定:NO检测法
9)GST pull-down:检测蛋白质
3. 统计分析
Shapiro-Wilk检验、Levene检验、配对或非配对双尾t检验、Dunnett检验的单因素方差分析、Kolmogorov-Smirnov检验、Kruskal-Wallis检验、Dunn多重比较检验、Pearson相关分析ROC。
研究结果
1.OA软骨细胞中ADMA的增加触发软骨变性
OA患者和患者软骨细胞的代谢组学证明了代谢产物的一系列改变(图1A)。LC-MS确认OA软骨细胞中ADMA水平升高,其异构体对称二甲基精氨酸(SDMA)的变化(图1B)。
微质体培养和3D琼脂糖培养结合衰老相关(SA)-β-半乳糖苷酶染色表明,ADMA减少了软骨细胞中ECM的沉积并诱导了软骨细胞衰老(图S1,C-E)。
低浓度的短脉冲刺激或长时间刺激下,ADMA的小鼠软骨细胞合成代谢因子、分解代谢因子MMP13和衰老标志物P21以剂量依赖的方式下调(图S1F)。
免疫组织化学染色证实,暴露于ADMA软骨中的II型胶原和聚集蛋白聚糖的表达降低(图S1H)。热板分析、旋转棒分析和开放场分析显示,注射ADMA的小鼠疼痛阈值和运动能力显著较低(图S1I),说明退化的软骨细胞中ADMA的增加会引发软骨退化和衰老。

图1 | DDAH1上调ADMA加速OA形成
2.下调的DDAH1负责OA中ADMA的升高
与非OA组织相比,DDAH1在OA组织中的RNA表达较低,而DDAH2的RNA表达较高(图S2C)。通过三种不同的OA动物模型表明,DDAH1在OA中被抑制,从而增加软骨细胞中ADMA水平(图1C-D)。
免疫印迹蛋白技术和免疫组织化学证实了DDAH1的缺失(图1H和图S3A),微质体培养和3D琼脂糖培养显示DDAH1−/−原代软骨细胞中ECM沉积较低(图1E-F)。
20周龄的DDAH1−/−小鼠中DDAH1缺失,显著加速了DMM诱导的OA小鼠的软骨退化(图1G),免疫组织化学显示DDAH1−/−小鼠软骨中II型胶原和聚集蛋白聚糖减少(图1H)。
3. 软骨特异性DDAH1参与OA进展
RT-PCR显示合成代谢因子(COL2A1和ACAN)减少,代谢因子(MMP3和MMP13)增加(图2A),聚集蛋白聚糖和COL2A1的蛋白表达显著DDAH1缺失后下调(图2B),软骨中DDAH1的缺失可能导致DMM术后严重的软骨损伤(图2C和图S5C)。
在Col2-CreERT2、DDAH1fl/fl和ACAN-CreERT2小鼠软骨中II型胶原和聚集蛋白聚糖的蛋白表达显著降低(图2D和图S5D),DDAH1fl/fl、Col2-CreERT2和DDAH1fl/fl、ACAN-CreERT2小鼠中则观察到较多的骨赘和较高的软骨下骨体积(图2E-F和图S5E-F)。
这些数据表明软骨特异性DDAH1敲除对OA进展至关重要,而DDAH1的过表达对OA具有治疗作用。关键合成代谢因子II型受损软骨中DDAH1过表达后,膝关节软骨中的胶原和聚集蛋白聚糖显著上调(图S6B)。
热板、旋转杆和6分钟距离法表明其疼痛阈值显著提高(图S6C)。LC-MS证实了DDAH1过度表达的软骨细胞可降低ADMA(图S6D)。表明DDAH1可部分逆转DMM诱导的OA。
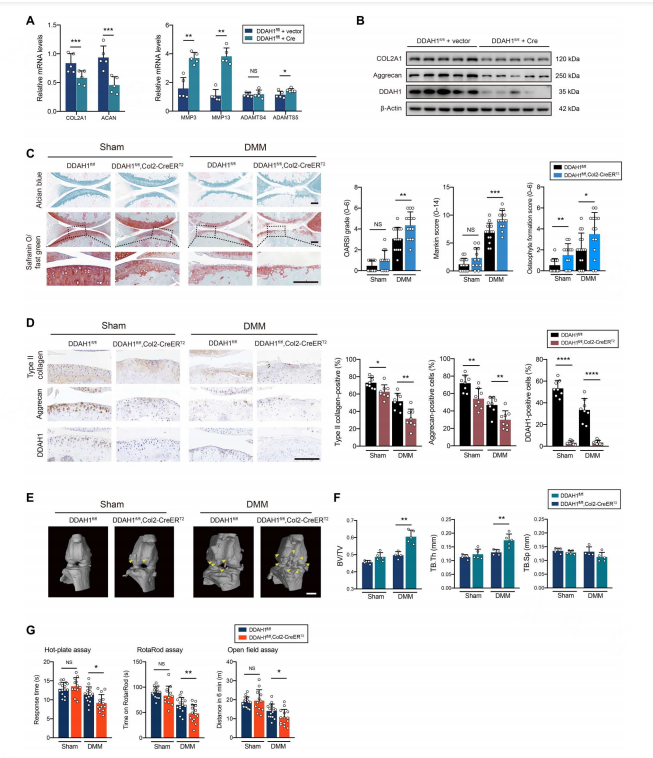
图2 | 软骨特异性敲除DDAH1加速OA进展
4.ADMA激活SOX9的泛素蛋白体途径
KEGG分析揭示了几种富集的OA相关途径,如ECM受体相互作用、TNF信号通路、细胞衰老和糖胺聚糖生物合成(图3A)。火山图显示了上调的分解代谢因子、衰老标志物和炎症趋化因子及下调的合成代谢因子(聚集蛋白聚糖、COL2A1和SOX9)(图3B)。在ADMA或DDAH1缺失的软骨细胞中,SOX9蛋白表达下调(图3D-E)。
免疫组织化学显示,SOX9的表达来自PD 404182或DDAH1fl/fl、Col2-CreERT2和DDAH1fl/fl,ACAN-CreERT2小鼠(图3F-H)。ADMA中的SOX9半衰期短于对照细胞,证明ADMA导致了SOX9的不稳定。而MG132阻断了SOX9的衰变而氯喹却没有,表明SOX9的降解依赖于蛋白酶体途径,而不是溶酶体途径(图3I-J)。
ADMA诱导了SOX9衰变,并在过表达的DDAH1软骨细胞中部分逆转,通过泛素-蛋白酶体途径触发了SOX9的降解,增加了SOX9的水平(图3 K -L)。
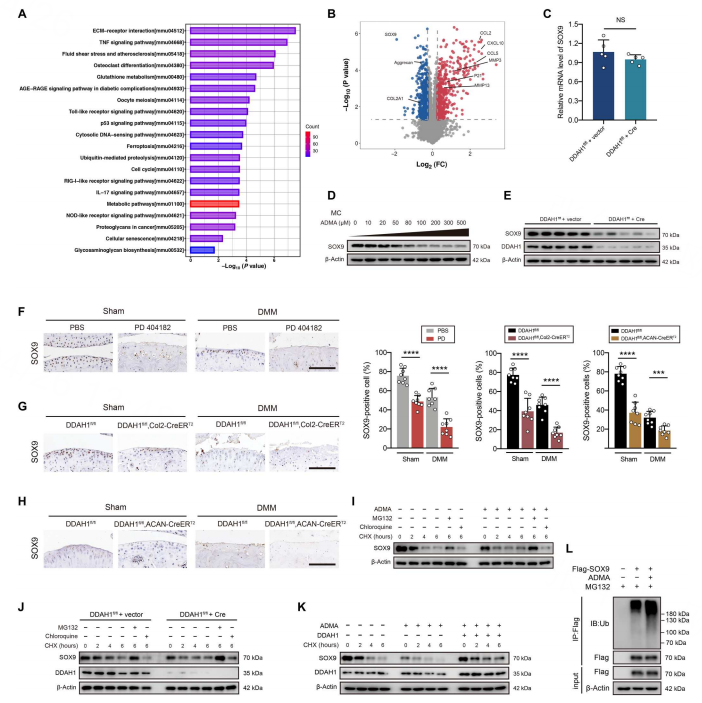
图3 | ADMA通过泛素-蛋白酶体途径诱导SOX9降解
5.ADMA阻断SOX9与USP7交互途径
UbiBrowser数据库预测生物素ADMA和SOX9相关E3泛素连接酶或去泛素化酶(DUBs),发现DUBsUSP7可能参与其中(图4A-B)。GST-SOX9和His-USP7重组蛋白与生物素ADMA分别孵育,发现SOX9和ADMA(或USP7和ADMA)之间存在直接相互作用(图4C-D)。
共聚焦显微镜显示USP7和SOX9共定位,ADMA处理细胞后,SOX9的荧光信号减弱,而USP7没有改变(图4-F)。分子对接技术预测ADMA、USP7和SOX9之间相互作用模型,发现ADMA可阻断SOX9和USP7之间的相互作用区域,并可减弱其相互作用(图4 G-H)。
ADMA刺激免疫印迹中SOX9蛋白水平导致不平衡,调整SOX9蛋白水平后发现,ADMA处理的软骨细胞中USP7和SOX9之间的相互作用减少(图4I)。GST下拉分析验证了USP7和SOX9之间的直接结合作用可被ADMA部分阻断(图4J)。
抑制USP7后,ADMA未能影响SOX9的表达和泛素粘附在SOX9上的表达 (图4K-L)。DMM术后1周,将USP7 AAV关节注射到DDAH1fl/fl、Col2-CreERT2小鼠膝关节,免疫组化结果显示,DMM术后8周软骨损伤得到明显修复,SOX9、II型胶原蛋白和聚集蛋白表达分别增加(图4M-N)。

图4 | ADMA阻止SOX9和USP7之间的交互途径
6. 滑膜液中的ADMA是一种潜在的OA诊断指标
近几十年来,OA的诊断主要依赖于临床症状和放射学。而在临床实践中,OA患者的软骨细胞和滑液中ADMA显著增加。ADMA能够区分OA患者和相对健康的患者,并且在早期诊断OA方面具有良好的敏感性和特异性。尽管需要更多的样本,但滑膜液中的ADMA可能仍然是OA诊断的潜在生物标志物。

图5 | 滑液中ADMA可预测OA的诊断
相关讨论
OA发病过程中,软骨细胞中的许多酶发生变化,导致一系列代谢变化,使其某些代谢产物可能是OA的诊断标志物,代谢产物ADMA的增加,伴随着DDAH1的下调。受DDAH1调节,ADMA通过促进软骨细胞变性和衰老而加速OA的发展,而不是依赖于NOS/NO通路。ADMA直接与SOX9和USP7结合,并阻断相互作用区域。
SOX9的降解依赖于蛋白酶体途径,而不是溶酶体途径,通过促进SOX9泛素-蛋白酶体途径进行降解,增加SOX9的水平。
研究结论
通过研究表明,OA软骨细胞滑液中ADMA显著增加,对早期OA诊断具有良好的敏感性和特异性,且能够区分OA患者和相对健康患者,说明滑液中的ADMA可能是诊断OA的潜在标志物,对OA早期诊断具有预测价值。ADMA的增加伴随着软骨细胞中DDAH1的下调,可在体内和体外诱导软骨细胞基质降解,促进软骨细胞变性和衰老,加速OA的进展。揭示了ADMA的靶点,并探讨了ADMA调节的潜在机制。
文章推荐
文章通过非靶向代谢组学技术、蛋白质组学技术、Nano–LC-MS/MS等技术,探究了ADMA在OA软骨滑液中的作用,及对OA早期诊断的预测价值。ADMA受DDAH1调节,揭示了ADMA的靶点,即靶向DDAH1可能为OA治疗提供新方向。
猜你还想看
◆厉害了!顶刊看好,打破传统维度的空间代谢组学如何「尽快去学」
◆项目文章 | AFADESI空间代谢组学探究小麦颖果氨基酸和有机酸对多基因响应~
◆首次公开 | 鹿明空间代谢组最新分析内容解析(数据挖掘必看)
END
小妮子 撰文
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章












