清华大学生科院Nature子刊解析翻译调控新机制
2014年11月2日,清华大学生命学院高宁、雷建林研究组共同在Nature Structural & Molecular Biology刊物上,在线发表文章“Structural basis for interaction of a cotranslational chaperone with the eukaryotic ribosome”。该论文报道了辅助新生肽链折叠的共翻译分子伴侣(co-translational chaperone)与酵母80S核糖体形成的复合物的冷冻电镜三维结构,并结合功能实验数据,首次揭示了共翻译分子伴侣调控蛋白翻译中的肽链延伸过程的分子机制。
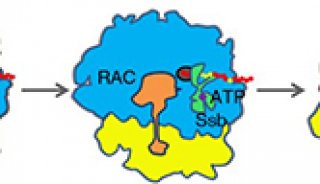
当新生肽链从核糖体上合成出来时,由于一些疏水氨基酸的暴露,新生肽链很容易发生聚集以及错误的折叠。为了避免上述情况的发生,生物体进化出了一些共翻译分子伴侣(co-translational chaperones),来保护新生肽链,并帮助新生肽链进行初步的折叠。RAC是真核生物中广泛存在的一类co-translational chaperones,从酵母到人都非常保守。酵母中RAC-Ssb系统共有三个蛋白组成,分别是Zuotin,Ssz以及Ssb。其中,Zuotin和 Ssz能形成稳定的二元复合物,并通过Zuotin结合到80S核糖体上,被称为Ribosome Associated Complex (RAC)。
最近两年的一些细胞生物学及生化数据表明,RAC/SSB对于翻译的准确性也是极为重要的,还发现RAC-Ssb的底物大多为易于聚集、翻译速率较慢的新生肽链,暗示着RAC/Ssb系统不仅发挥着分子伴侣的功能,还可能对核糖体的翻译有一定的调控作用。然而,无论是RAC/Ssb的新生肽链保护功能还是其可能的翻译调控功能,它们的具体分子作用机制都知之甚少。
在这篇文章中,研究人员通过冷冻电镜三维结构表明:Zuotin通过一个中间的螺旋结构域(Middle domain)“交联”了80S核糖体的大小两个亚基,这一“交联”使得核糖体亚基间的相互运动受到限制。以往针对核糖体结构的研究表明核糖体亚基间的相互旋转运动是所有物种核糖体的一种高度保守的构象变化模式。每当核糖体上的新生肽链延伸一个氨基酸的长度,核糖体大小亚基间都会发生一次旋转-反旋转的构象变化循环。
进一步的结构分析表明,Zuotin的结合能对核糖体的旋转状态进行调控,改变了核糖体亚基间的旋转构象的分布,从而能够降低翻译延伸的速率,有利于对新生肽链的保护。作为进一步的模型验证,细胞生物学实验证明Zuotin的middle domain的长度、完整度以及刚性的变化都会不同程度的影响其在细胞内的功能。
这些工作表明真核核糖体介导的蛋白翻译存在一种全新的调控机制:共翻译分子伴侣RAC通过对核糖体的亚基间构象变化的调控来控制肽链的延伸,从而使得新生肽链的折叠速度和肽链延伸速度得到同步。这些数据揭示了一条由新生肽链的早期折叠对于翻译的反馈调控通路,对进一步的研究共翻译分子伴侣的翻译调控功能有着重大的指导意义。
清华大学生命学院2010级博士生张一小为本文第一作者,清华大学生命学院高宁和雷建林为共同通讯作者。清华大学生命学院俞立教授及其博士生朱婧协助了酵母菌株的构建。本研究得到了国家基金委自然科学基金,科技部重大研究计划,清华大学自主科研项目的资助,数据处理和结构计算得到了国家蛋白质科学基础设施(北京)和清华大学“探索100”高性能计算平台的支持。
图:RAC对于核糖体上的蛋白翻译过程的调控。
-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件