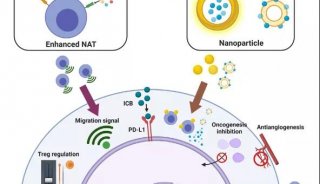
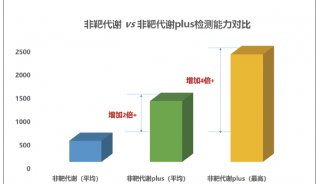
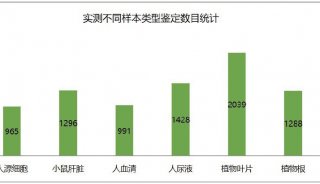
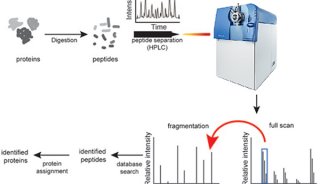
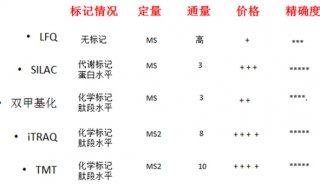
RF3通过提前释放新生肽链,维持蛋白质稳态的新机制
蛋白质如何实现正确折叠是生物学尚未解决的一个重大问题。上世纪60年代,诺奖获得者Anfinsen提出了经典概念:“蛋白质的结构是由其氨基酸序列决定,并可在体外变性后自发地重新折叠成天然构象”。随着蛋白质折叠研究的广泛开展,马普生化所的Ulrich Hartl教授和普林斯顿大学的Arthur Horwich教授进一步完善了该理论,揭示了“伴侣蛋白对蛋白质折叠有着非常重要的调节作用”。在蛋白质合成早期,蛋白质折叠与核糖体翻译共同起始,并受到伴侣分子的精密调控。极细微的蛋白质异常折叠将导致疾病的发生。虽然伴侣蛋白在蛋白质折叠的重要性得到证实,但其在核糖体上的调控机制尚不清楚。
在生命“中心法则”中,核糖体是实现mRNA翻译到蛋白质的细胞机器。核糖体合成蛋白质分为四个阶段:起始、延伸、终止和回收。其中参与翻译终止的是释放因子,按功能分为两类,I类能识别终止密码子,并通过水解tRNA释放出完整的新生肽链,如原核生物中的RF1和RF2;II类具有GTP酶活性,可辅助I类因子进入肽基转移酶中心,如原核生物中的RF3。此外,RF3也参与缺陷蛋白的质量控制。虽然很多因子“监督”核糖体的蛋白合成,但是,是否有因子能感应伴侣蛋白网络的紊乱并使核糖体作出应答仍是未解之谜。
2021年6月8日,德国马克斯普朗克生物化学研究所Ulrich Hartl团队 (第一作者为赵樑博士) 在Molecular Cell杂志上发表了题为Bacterial RF3 senses chaperone function in co-translational folding 的文章。研究揭示了在伴侣蛋白网络发生紊乱时,RF3通过提前释放错误折叠的新生肽链,保障核糖体的合成效率,进而维持蛋白质稳态的新机制。

该研究使用大肠杆菌作为模式生物,应用定量蛋白质组学鉴定了与核糖体上新生肽链相互作用的伴侣蛋白网络,其中Trigger factor (TF)、DnaJ和DnaK是丰度最高的伴侣蛋白。当敲除TF后,DnaK增加了与核糖体上新生肽链的相互作用;而当敲除上游的伴侣蛋白DnaK后,下游的分子伴侣GroEL、HtpG和ClpB在核糖体上的数量增多。这表明了伴侣蛋白网络有益互补,共同促进新生肽链的折叠。
当伴侣蛋白网络有缺陷时,必然伴随着新生肽链的错误折叠,核糖体是否有应对之策?为了回答这个问题,通过敲除或使伴侣蛋白功能紊乱时,质谱分析核糖体相互作用蛋白的变化,发现RF3特异性地富集并增加与核糖体的相互作用,随后,通过RF2的辅助,提前终止错误折叠新生肽链的合成并释放,促使其降解。这样有效地保证了核糖体合成蛋白质的能力。相反,当敲除RF3和伴侣蛋白之后,错误折叠的新生肽链会阻滞在核糖体上,造成功能核糖体数量大幅减少,从而抑制细胞的生长。分子机制上,在正常细胞生长条件下,DnaK通过与RF3绑定,“沉默”部分RF3的功能;而当伴侣蛋白网络发生紊乱时,RF3就会被释放,进而与核糖体结合影响其功能。
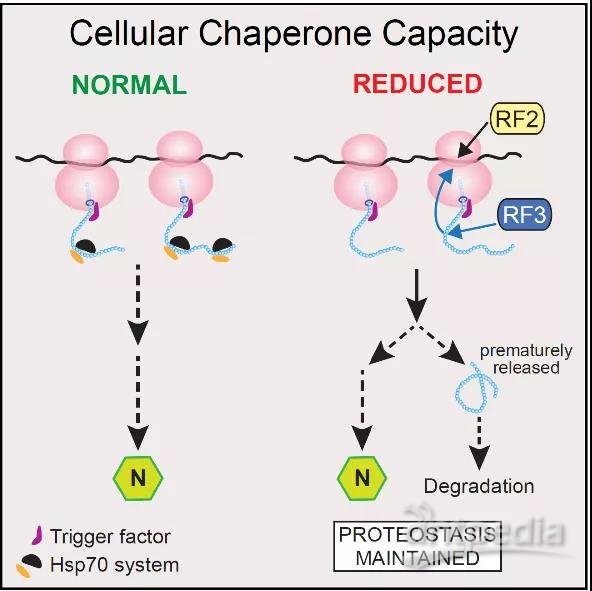
综上所述,本研究首次发现了伴侣蛋白网络在核糖体蛋白质合成过程中的关键作用,并挖掘了一个关键的调控蛋白RF3。该项研究有望为由蛋白质错误折叠诱导的神经退行性疾病的治疗提供新策略。
-
企业风采

-
企业风采

-
精英视角

-
精英视角

-
技术原理
-
产品技术

-
投融资

-
企业风采

-
企业风采

-
会议会展

-
综述
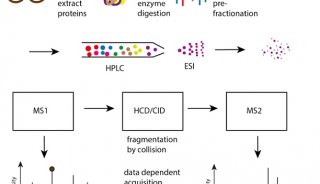
-
焦点事件

-
焦点事件

-
企业风采
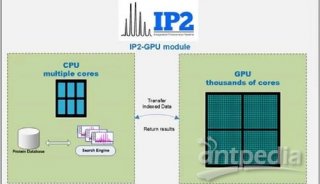
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
技术原理