2016“引文桂冠奖”得主最新Cell评述文章
纪念斯隆-凯特琳癌症中心的总裁和首席执行官Craig Thompson是一位著名的癌症研究领域科学家,他今年由于解释了CD28和CTLA-4如何激活T细胞的机制而入选了汤森路透公布的“引文桂冠奖”,这一奖项自2002年起预测诺贝尔奖,已经有39人真正荣获了这一最高科学奖。
在最新一期(9月22日)的Cell杂志上,Thompson教授发表题为“Into Thin Air: How We Sense and Respond to Hypoxia”的评述文章,向大家介绍了今年拉斯克奖基础医学研究奖关于“人与动物对氧气含量的细胞感知机制”。
今年基础医学研究奖的三位学者William Kaelin、Peter Ratcliffe、Gregg Semenza,致力于人体和大多数动物细胞感知与适应氧气变化的机制研究。
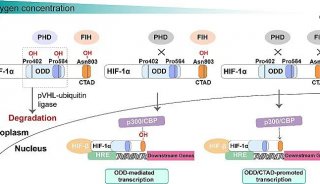
氧气在我们生活中扮演了重要的角色,比如当我们在高海拔地区活动时,身体会出现异常变化,人体的新陈代谢发生变化,开始生长出新的血管,制造新的红细胞。这几位科学家们想做的正是找出这种身体反应背后的基因表达,为什么在氧气含量低的时候,肾脏细胞中的某种基因会开启,其中Semenza所发现的开关是一种很普通的蛋白质,叫做缺氧诱导因子 (Hypoxia-inducible factors, HIF)。自在上世纪90年代发现HIF-1α以来,Semenza及其研究小组一直从事HIF-1α研究,在不同类型的细胞中精确寻找被这一活化蛋白促进或抑制的大量基因。
来自Dana-Farber癌症研究院的Kaelin教授则一直致力于缺氧在肿瘤中的影响,他在视网膜母细胞瘤、von Hippel-Lindau(VHL)和P53肿瘤抑制因子方面的研究提示纠正单个基因缺陷可产生一定的治疗效果。其中对VHL蛋白的研究在VEGF抑制剂成功治疗肾癌方面功不可没。今年七月,其研究组还证实在乳腺癌中谷氨酸旁分泌诱导HIF促进了癌变,这一研究成果公布在Cell杂志上。
今年的另外一篇论文还提出,当线粒体功能受到影响时,p53就被诱导。这表明它有可能不依赖HIF-1α通路而促进肿瘤的生长。研究人员证明,在mtDNA被去除的细胞中,p53可通过阻止HIF-1α与本应该结合的基因启动子结合,并通过促进HIF-1α的泛素化——在细胞中标记蛋白用以降解的过程,而干扰HIF-1α。
Thompson教授在文章最后指出,机体内氧气不再仅仅参与ATP生成,越来越多的研究表明这个元件在细胞分化,免疫防御,组织修复调控等多方面发挥重要作用。
德国科学家Otto Heinrich Warburg因为研究线粒体呼吸链而获得诺贝尔奖,他在1924年还提出了一个发现:癌症细胞与正常细胞的代谢途径不一样,癌细胞主要通过糖酵解(Glycolysis)来代谢葡萄糖,而正常细胞则主要用线粒体呼吸链(Oxidative Phosphorylation)代谢葡萄糖,这就是著名的Warburg效应。但在很长的时间里,这个发现没有引起科学家们的注意。Craig Thompson是最早重拾Warburg effect并进行深入研究的科学家之一。