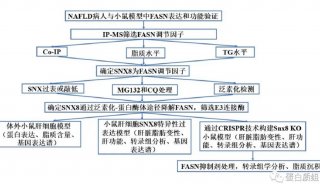
Nature | 仅隔两周,蛋白质组再揭肿瘤新靶点
继两周前,nature上发表了利用蛋白质组学发现胰腺癌治疗靶点和诊断标志物的突破性成果后(添加该文链接)。5月2日,又一篇卵巢癌新靶点的文章在nature上重磅发表!!还是那个蛋白质组,却是肿瘤领域又一重要新发现!!!
肿瘤转移一直是困扰癌症治疗的一大问题。5月2日,来自芝加哥大学的Ernst Lengyel研究团队在顶级期刊Nature在线发表了题为“Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts”的研究。
研究人员利用蛋白质组分析,找到了介导卵巢癌转移的“帮凶” ---NNMT(nicotinamide N-methyltransferase),而该关键靶标蛋白有望成为抑制卵巢癌细胞转移的干预靶点。
Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts
Nature IF= 41.577
原文链接:
https://www.nature.com/articles/s41586-019-1173-8
研究背景:
高级别浆液性卵巢癌(High-grade serous carcinoma, HGSC)一直存在预后效果差的问题,而早期的腹腔转移更是其导致不良预后的首要因素。
以往,多篇组学文章描绘了卵巢癌的蛋白表达特征,然而还没有文章进一步区分癌细胞与癌细胞周边基质的差别。HGSC组织具有高比例的基质,鉴于基质对肿瘤有支撑作用,并且基质在肿瘤发展和转移过程中与上皮共同进化。因此,系统性地对肿瘤及其周围基质进行分析,能够帮助我们更深入地理解卵巢癌转移机制。
研究方法:
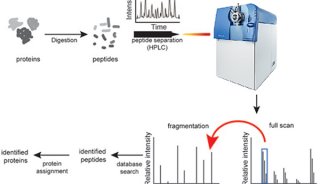
采用激光捕获显微切割+高灵敏度蛋白质组学,从11位HGSC病人石蜡包埋组织中提取了107个肿瘤组织与肿瘤周边基质,随后进行蛋白质组分析。
研究材料:
107个肿瘤组织、肿瘤周边基质;HGSC转移的小鼠模型
研究结果:
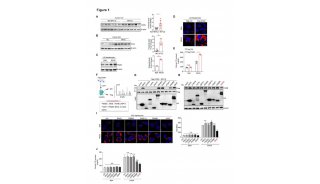
1、蛋白质组分析:揭示HGSC转移特征、挑选潜在调控肿瘤转移的因子
蛋白质组分析共鉴定到6944个蛋白。在肿瘤组织中,鉴定到了几个已知的HGSC的标志物(PAX8,MSLN,MUC16, EPCAM),而在基质部分,则鉴定到一些成纤维细胞激活的标志物(collagens, vimentin, versican, tenascins,myosin)。进一步比较原发肿瘤和转移肿瘤之间差异,研究人员发现了许多差异蛋白,且有许多是已报道的参与网膜转移的蛋白。在对基质组分的分析中,作者一共鉴定到62个蛋白显著差异蛋白,通过差异筛选与文献调研,研究人员最终选择了一个参与表观遗传调控的蛋白----NNMT进行深入研究。
图1.肿瘤组织、周边基质的蛋白质组学揭示了HGSC转移的特征
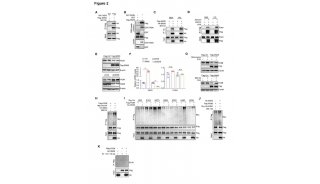
2、验证并探究NNMT功能:NNMT在肿瘤转移基质中高表达且调控CAF表型
NNMT是参与表观遗传调控的因子,其能通过影响组蛋白的甲基化来调控基因表达。为了验证NNMT是否是肿瘤转移的“帮凶”,研究人员首先利用免疫组化验证了NNMT确实是在网膜转移的肿瘤基质中呈现高表达。
随后,研究人员进一步研究NNMT对于调控CAF表型作用,以确定其在肿瘤转移中发挥的功能。肿瘤转移相关成纤维细胞(cancer-associated fibroblast,CAF)是体内产生的成纤维细胞,癌细胞可以劫持并利用它们来维持自己的生长和转移。研究发现,在CAF中敲低NNMT会使细胞形态更加趋向于正常细胞。此外,NNMT不仅能调控胶原蛋白的收缩性,而且能调控上千种基因的表达,包括一些促癌细胞因子。
图2. NNMT在肿瘤转移基质中高表达且调控CAF表型
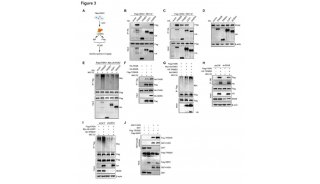
3、NNMT的调控机制探究:NNMT 通过调控DNA和组蛋白的甲基化驱动CAF表型
随后,结合以往报道的NNMT功能及深入机制探究,研究人员发现,NNMT通过降低DNA、RNA或者组蛋白的甲基化水平,改变基因表达水平,进而调控CAF的表型。
4、小鼠肿瘤转移模型与临床数据验证:基质的NNMT参与了肿瘤转移进程并且与预后不良相关
最后,研究人员利用小鼠模型对该发现进行验证。利用过表达NNMT细胞的培养基预处理的卵巢癌细胞后,将卵巢癌细胞接种到小鼠模型体内,发现其网膜转移显著高于对照组。相反,如果将NNMT敲低的细胞与HGSC细胞共同注射到小鼠体内,肿瘤细胞的增殖和肿瘤大小则显著降低。
此外,临床数据的分析也验证了这一结论。研究发现,基质中NNMT高表达的病人生存期更短且预后更差,而在肿瘤组织中NNMT高表达的病人却并没有显著差异。
图4 基质的NNMT参与了肿瘤转移进程并且与预后差相关
5、结论
NNMT是维持CAF细胞表型的关键调控分子,其在卵巢癌的发生发展以及转移过程中扮演重要角色。
小编总结:
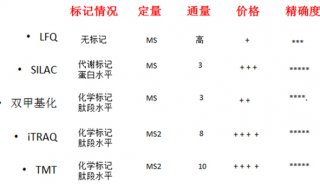
本文是利用蛋白质组研究肿瘤发生、发展、转移的又一力作。在蛋白质组学方面,中科新生命拥有丰富、全面蛋白质组学产品及一站式服务:从常规蛋白质组、全扫描蛋白质组(DIA)、到PRM验证,此外还有转录+蛋白、蛋白+代谢联合分析,我们致力为您提供完整的解决方案。
索取资料
来源:上海中科新生命生物科技有限公司
联系电话:021-54665263
E-mail:marketing@aptbiotech.com
-
科技前沿

-
综述
-
焦点事件
-
项目成果