老年痴呆元凶——APOE三兄弟(一)
痴呆(Dementia)的种类很多,除了阿尔茨海默症(Alzheimer disease,AD,也叫老年痴呆)以外,还有血管性痴呆(Vascular dementia),额颞叶痴呆(Frontotemporal dementia)和路易小体痴呆(Dementia with Lewy bodies)等。其他疾病如亨廷顿综合征(Huntington disease)或帕金森综合症(Parkinson disease)也伴有痴呆症状产生。不过,AD是所有痴呆中占比最大的,达到6到7成。接下来就是血管性痴呆和额颞页痴呆,分别占比约为10-20%和10%,剩下的痴呆类型相对较少。不仅在痴呆中占有最大的比例,AD也是神经退行性疾病中占比最多的,甚至超过了其余神经退行性疾病病患数量的总和。
从症状上看,AD会影响病患的空间记忆,具体表现为在熟悉的地方会迷路;其次会频繁忘记刚刚做过的事情,比如忘记自己吃过午饭;还有就是对于以往非常熟练的技能会变得很生疏;逐渐忘记朋友甚至亲人的名字;时间概念混乱。到后期还会逐渐出现情绪暴躁、回避社交行为以及语言功能障碍等问题,最后生活不能自理直至各种器官衰竭而死去。

图1. 阿尔茨海默症症状及其在痴呆中的比例[1, 2]
阿尔茨海默症负担沉重但科研投入不足
这样严重的疾病常常被我们当做是“老糊涂”了,在症状初期没有给予足够的重视,任其发展到晚期时已无可挽回。据美国国立卫生研究院(NIH)2015年的统计,该年美国投入在癌症研发上的经费为50亿美元,而投入在阿尔茨海默病上的只有5亿美元;但是,美国全社会却承担着由阿尔茨海默症带来的2000亿美元的沉重负担,而所有癌症造成的负担加起来只有AD的一半;另一方面美国每年因阿尔茨海默病死亡的人数与罹患癌症而死的人数几乎相等。阿尔茨海默病之所以造成如此之重的经济负担,除了对病患的治疗费用以外,更大的花费在对于患者的看护上,而且AD发病后相对癌症而言持续时间长,需要占用看护者的大量时间和精力,并剥夺了其创造社会价值的机会成本。

图2. 2015年美国阿尔茨海默病与癌症研发投入对比[3]
阿尔茨海默症假说及药物研发现状
随着多年来对AD研究的深入,我们已经了解到AD有两大病例特征,即患者脑中会存在大量由Aβ(Amyloid Beta)聚集而成的淀粉样沉淀和由tau聚集而成的神经纤维缠结,其中Aβ由APP(Amyloid Precursor Protein)经过两次剪切而成(BACE1剪第一刀,含有PS1/2的γ剪切酶负责补上一刀),tau蛋白则由MAPT(微管结合蛋白tau)基因编码而来,并被过度磷酸化而聚集成纤维缠结。虽然现在我们投入巨大精力研究了APP,Aβ,BACE1(β-Secretase),PS1(γ-Secretase的组成部分)以及tau,并以这些蛋白作为靶点开发药物,但这些药物在最终临床阶段几乎全部折戟沉沙。目前获批的药物仅仅是三种乙酰胆碱酶抑制剂和一种NMDA受体(一种介导神经兴奋性的受体)的抑制剂以及和肠道菌群相关的GV971,而且GV971目前机理不明确且没有获得广泛使用,而前面几种只能暂时缓解AD症状,并不能起到治疗AD的作用,甚至连延缓病程也无法做到。
所以几十年的研究中人们虽然对AD的认识在不断深化,但在治疗上并不像肿瘤和艾滋病以及传染性疾病上那样有实质性的突破。在临床、动物、细胞等实验中各种不一致的现象让AD的机理更加扑朔迷离。另外值得注意的是,在临床前的模式动物研究中,主要的基因编辑对象是Aβ源头蛋白APP,以及γ剪切酶中的PS1以及β剪切酶(BACE1),其中前两种基因的一些突变会造成AD发病程度的加重和发病时间的提前。我们把这两种基因突变造成的AD称为早发型AD。但这种遗传性AD病例在所有的患者中只占不到5%的比例。真实情况是大部分病例是散发性的,即发病时间一般在65岁之后,并且也没有APP和PS1的突变。而临床实验中面对的大部分病例属于散发型,这或许是在模式动物中形势喜人的药物进入临床后期后,效果令人失望的原因。
而另一个AD中形成神经纤维缠结的tau蛋白编码基因MAPT,其突变并不会直接造成Aβ的聚集,也不会产生淀粉样沉淀。MAPT的突变是额颞叶痴呆的主要诱因之一,但AD却几乎与这种突变无关。AD病患脑中的tau聚集目前主流认为是Aβ或者炎症引起的。针对该蛋白,虽然人们制作了很多基因编辑小鼠进行临床前研究,也的确提升了我们对AD的了解,但针对tau作为靶点的药物目前暂无令人振奋的结果。

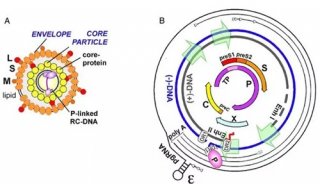
图3. 阿尔茨海默症的Aβ假说[4]
-
政策法规

-
焦点事件

-
科技前沿