实验室分析仪器--有机质谱仪生物样品的制备方法介绍
生物样品通常是指植物的根、茎、叶、花、种子等动物(包括人)的呼吸气体、体液(如尿、血、唾液、淋巴液、胆汁、胃液及生物体内的其他分泌液等)、毛发、肌肉和组织器官(如胸腺、胰腺、肝、肺、脑、胃、肾等)和器官内异常物(如结石、肿瘤等)以及各种微生物。常见的待分析检测组分包括植物体内的营养成分及有害成分如农药残留等、动物体内的药物、代谢产物、糖类及有关化合物、脂类及长链脂肪酸化合物、维生素及辅酶类化物、氨基酸、多肽、核苷、核苷酸及其衍生物、磷酸酯类化合物、固醇类化合物、胺、酰胺蛋白质和一些生物大分子(相对分子质量在数千到数百万之间)。这些待测组分的检测大多数都可采用气相色谱、液相色谱、电化学分析等方法,而用质谱法分析其中的有机物组分是目前最为灵敏、高效、高特异性、高通量、快速的分析方法。
用质谱法测定时,随着测定对象、测定目标及所使的仪器及方法的不同,除少数可原位直接分析外,大多数样品在分析之前都要经过采集、分离纯化等繁杂的样品预处理步骤。
一、生物材料的采集与前处理
生物材料的选择与采集要依据实验的目的及采用的质谱仪器与方法来确定。应注意的是,生物材料所含的组分不是一成不变的,如动物材料中的各种组分处于不同的生理状态时有很大差别,故选材时还要考虑时间、地区等因素。实验材料的选择是否合理,不仅关系到实验进行的难易,而且也常常是实验成败的关键。
实验材料选定后,需对其进行预处理,以除去一些与实验无关甚至有干扰的成分。如植物样品的脱水处理,血样要立即加抗血凝剂;动物组织一般用缓冲盐溶液洗去残留血液和污染物并加防腐剂;微生物材料需将菌体和发酵液分开等。对预处理好的材料,如不能立即进行实验,则应冷冻保存,对动物材料应深度冷冻以尽可能保持新鲜,避免待测组分受到周围环境条件的影响;另外,采样工具和盛样器皿要经过消毒处理,最好在无菌的条件下采样。
二、细胞的破碎与细胞器的分离
实验材料进行预处理后,接下来就是选用适当的方法将组织细胞破碎,让处于细胞不同位置的待纯化的蛋白质或核酸释放出来,是蛋白质和核酸初级分离纯化阶段的重要环节。
1.细胞的破碎
根据作用方式不同,细胞破碎基本可以分为两大类:机械法和非机械法。传统的机械法包括匀浆、研磨、压榨、超声等。非机械方法包括物理法、化学法及生物化学法。每种方法都有其各自的使用范围和优缺点。不同的实验规模、实验材料和实验要求,使用的破碎方法和条件也不同。对比较柔软的组织如肝、脑等,用普通的玻璃匀浆器即可达到完全破碎细胞的目的,而对一些坚韧组织如肌肉,则需要剧烈的绞碎或研磨作用,才能把其组织细胞破坏。对同样一种实验材料,实验要求不同,如制备大分子的核酸和制备小分子的核苷酸,对细胞破碎的方法和条件也不相同,后者可以采用剧烈手段,而前者则必须保持十分温和的条件才不至于损坏分子的完整性。各种组织和细胞常用的裂解方法如表1所示。
细胞破碎方法 | 组织种类 |
旋刀式匀浆 | 大多数动、植物组织 |
手动式匀浆 | 柔软的动物组织 |
超声 | 细胞混悬液 |
高压匀浆 | 细菌、酵母、植物细胞 |
高速研磨 | 细胞混悬液 |
酶溶 | 细菌、酵母 |
去垢剂渗透 | 组织培养细胞 |
有机溶剂渗透 | 细菌、酵母 |
低渗裂解 | 红细胞、细菌 |
冻融裂解 | 培养细胞 |
表1 各种组织和细胞常用的裂解方法
2.细胞器的分离
细胞器包括细胞核、线粒体、核糖体、内质网溶、酶体、高尔基体、叶绿体、液泡、中心体等。各类生物大分子在细胞内的分布是不同的,如DNA几乎全部集中在细胞核内,而RNA大部分分布于细胞质中,各种酶在细胞内的分布也有一定的位置,分离各种细胞器上的各类核酸和特异性蛋白质已经成为生物大分子制备工作的重要内容之一。
细胞器的分离,一般采用差速离心法。细胞经过破碎后,在适当的介质中进行差速离心,利用细胞各组分质量的不同,沉降于离心管内的不同区域,分离后即得所需要的组分以作为下一步提取纯化的材料。如果所需要的目标蛋白质与细胞膜或膜质细胞器结合在一起,则必须用超声波或去污剂等使其与膜结构解聚。细胞器的分离制备、介质的选择是十分重要的。最早使用的介质是生理盐水,但因为生理盐水易使各亚细胞颗粒发生聚集作用,结成块状沉淀而影响分离效果,现一般改用蔗糖。蔗糖使介质具有足够的渗透压,可以防止颗粒膨胀和破裂。如蔗糖蔗糖干扰酶的鉴定,可用甘露醇来代替。柠檬酸可以用于细胞核和线粒体的分离,而Ficol(一种蔗糖多聚体)是一种理想的介质,很多情况下可用于动物细胞器的分离。
三、蛋白质的分离和纯化
蛋白质是生命的物质基础,各种动植物及微生物均含有相当量的蛋白质。质谱检测目标化合物时,若需检测的目标化合物为小分子化合物与多肽,常需把蛋白质除去,以防止蛋白质对目标化合物测定的干扰;若质谱检测的目标化合物为蛋白质及核酸等,则需将蛋白质取出来,并进行必要的纯化,甚至进一步进行专一性裂解反应或聚合酶链式反应(PCR技术)。
1.蛋白质(包括酶)的提取
提取是将经过处理或破碎的细胞,置于一定的溶液中,让待提取的生物大分子充分释放出来并与细胞中其他生物大分子分离的过程。影响提取的主要因素有待提取物质在提取溶液中溶解度的大小、由固相扩散到液相的难易程度、溶剂的pH值及提取时间。某一物质在溶剂中溶解度的大小与该物质的分子结构及溶剂理化性质有关,一般遵守“相似相溶”原则。此外,通过搅拌减小溶剂的黏度、延长提取时间等可以增加提取效率。提取一般遵守“少量多次”的原则。
大部分蛋白质都可溶于水、稀酸、稀盐或稀碱溶液,少数与脂质结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中。蛋白质在不同溶剂中的溶解差异,主要取决于蛋白质分子中非极性疏水基团与极性亲水基团的比例,其次取决于这些基团的排列和偶极矩。所以,分子结构是不同蛋白质溶解度差异的内因,温度、pH值、离子强度等因素是影响蛋白质溶解度的外因。表2给出了一些不同结构蛋白质的溶解性质,表3列出两类提取方法的适应范围和注意事项。
蛋白质类别 | 溶解性质 | |
简单蛋白质 | 白蛋白 | 溶于水及稀盐、稀酸及稀碱溶液,可被5%(饱和度)硫酸铵析出 |
球蛋白 | 真球蛋白 | 一般在等电点时不溶于水,但加入少量的盐、酸、碱则可溶解 |
拟球蛋白 | 溶于水,可被5%(饱和度)硫酸铵析出 | |
醇溶蛋白 | 溶于70%~80%乙醇中,不溶于水和无水乙醇 | |
壳蛋白 | 在等电点时不溶于水,也不溶于稀盐溶液,易溶于稀酸、稀碱溶液 | |
精蛋白 | 溶于水和稀酸,易在稀氨水中沉淀 | |
组蛋白 | 溶于水和稀酸,易在稀氨水中沉淀 | |
硬蛋白 | 不溶于水、盐溶液、稀酸及稀碱 | |
缀合蛋白质(包括磷脂蛋白、黏蛋白、糖蛋白、核蛋白、血红蛋白,金属蛋白、黄素蛋白和氮苯蛋白等) | 此类蛋白质溶解度性质随蛋白质与非蛋白质结合部分的不同而异,除脂蛋白外,一般可溶于稀酸、稀碱及盐溶液中;脂蛋白如脂肪部分露于外,则脂溶性占优势;如脂肪部分被包围于分子之中,则水溶性占优势 |
表2 不同结构蛋白质的溶解性质
方法 | 适用范围 | 注意事项 |
水溶液提取法 | 能溶于水、稀酸、稀盐、稀碱的蛋白质或酶 | 1~5倍提取溶剂,多次提取,均匀搅拌,低温操作,选择适当pH值和盐浓度 |
有机溶剂提取法 | 与脂质结合比较牢固或分子中非极性侧链较多的蛋白质或酶 | 低温操作 |
表3 蛋白质提取方法
2.蛋白质的分离纯化
蛋白质的分离纯化方法很多,根据蛋白质溶解度不同的分离方法有盐析法、等电点沉淀法、低温有机溶剂沉淀法等;根据蛋白质分子大小差别的分离方法有透析与超滤法、凝胶过滤法等;根据蛋白质带电性质进行分离的方法有电泳法、离子交换法等;根据配体特异性的分离方法有亲和色谱法等。表4列出了主要分离方法的适用范围和注意事项。
方法 | 原理 | 注意事项 |
盐析法 | 根据蛋白质溶解度不同的分离方法 | 温度,pH值,蛋白质浓度 |
等电点沉淀法 | 根据蛋白质溶解度不同的分离方法 | pH值 |
低温有机溶剂沉淀法 | 根据蛋白质溶解度不同的分离方法 | 低温下进行 |
透析与超滤法 | 根据蛋白质分子大小差别的分离方法 | 滤膜孔径 |
凝胶过滤法 | 根据蛋白质分子大小差别的分离方法 | 柱填料常用葡聚糖凝胶和琼脂糖凝胶 |
电泳法 | 根据蛋白质带电性质进行的分离方法 | 不同蛋白质在电场中迁移速率不同 |
离子交换色谱法 | 根据蛋白质带电性质进行的分离方法 | 正负电荷吸引 |
亲和色谱法 | 根据配体特异性的分离方法 | 特异非共价结合 |
表4 蛋白质分离纯化方法
四、核酸的提取与PCR技术
核酸分为两大类:一类为核糖核酸(RNA),另一类为脱氧核糖核酸(DNA),它们都是由碱基、磷酸和核糖或脱氧核糖组成的一个个核苷酸,然后每个核苷酸再通过磷酸二酯键聚合而成的高分子化合物。核酸的分子量很大,从数万(转移RNA)到数千万甚至亿万(染色体DNA),分子高度不对称。核酸是两性化合物,有一定的等电点,能与金属离子结合成盐,又能与碱性物质结合成复合物。由于核酸分子组成中磷酸酸性与碱基碱性相比,较占优势,故其水溶液呈酸性。核酸类化合物都溶于水,不溶于乙醇等有机溶剂。在细胞内,核酸通常与蛋白质结合,以核蛋白的形式存在。核蛋白是蛋白质的一种类型,核糖蛋白和脱氧核糖蛋白在不同浓度电解质溶液中的溶解度有显著区别。用不同浓度的氯化钠溶液,可从破碎的细胞中分别将RA和DNA提取出来。
核酸的分离中,最困难的是将核酸与紧密结合的蛋白质分开,而且还要避免核酸的降解。常用的解离剂是阴离子去垢剂,如脱氧胆酸钠、十二烷基硫酸钠(SDS)、4-氨基水杨酸钠和萘-1,5-二磺酸钠等,它们具有溶解病毒和细菌、抑制核糖核酸酶的作用,可使核酸从蛋白质中游离出来。另外,除去核酸中蛋白质的一个有效办法是用酚-氯仿混合液,它们可使蛋白质变性并对核糖核酸酶有抑制作用,氯仿密度大可使有机相和水相完全分开,减少残留在水相中的酚。在用酚-氯仿抽提核酸提取液时,还需要剧烈振摇,为防止起泡和促使水相与有机相的分离,在酚-氯仿抽提液中再加上一定量的异戊醇。
1.核酸的提取与纯化
核酸的纯化最关键的步骤是去除蛋白质,通常只要用酚-氯仿、氯仿抽提核酸的水溶液即可。如果从细胞裂解液等复杂的分子混合物中纯化核酸,则要先用某些蛋白水解酶消化大部分蛋白质后,再用有机溶剂抽提。这些广泛的蛋白酶包括链酶蛋白酶、蛋白酶K等,它们对多数天然蛋白质均有活性。用酚氯仿两种溶剂合用,比单独用酚抽提除蛋白效果更佳。用氯仿抽提可除去核酸制品中的痕量酚。
2.PCR技术
PCR即聚合酶链式反应(ploymerase chain reaction),又称无细胞分子克隆系统或特异性DNA序列体外引物定向酶促扩增法,是基因扩增技术的一次重大革新,可将极微量的靶DNA特异地扩增上百万倍,从而大大提高对DNA的分析和检测能力,能检测单分子DNA或检测每10万个细胞中仅含有1个靶DNA分子的样品。PCR技术具有简便、快捷、灵敏的特点,已在基因获取、基因定点突变、基因检测等方面广泛应用。
PCR技术可以用已知的基因为模块,迅速、大量地获取所需的基因,也可以用反转合成的单链cDNA为模板,合成所需的双链cDNA。
PCR扩增DNA的原理是:先将含有所需扩增分析序列的靶DNA双链经热变性处理,开为两个低聚核苷酸单链,然后加入一对根据已知DNA序列、由人工合成、与所扩增的DNA两端邻近序列互补的低聚核苷酸片段作为引物,即左右引物。此引物一般需20~30个碱基对,过少则难保持与DNA单链的结合。引物与互补DNA结合后,以靶DNA单链为模板,经链杂交变性(退火),在 Taq DNA聚合酶的作用下,以4种三磷酸脱氧苷(dNTP)为原料按5’到3’方向将引物延伸自动合成新的DNA链,使DNA重新复制成双链,然后又开始第二次循环扩增。引物在反应中不仅起引导作用,而且起着特异性的限制扩增DNA片段范围大小的作用。新合成的DNA链含有引物的互补序列,并可作为下一轮聚合反应的模板。如此重复上述DNA模板加热变性双链解开-引物退火复性-在DNA聚合酶作用下的引物延伸的环过程,使每循环延伸的模板又增加一倍,亦即扩增DNA产物增加一倍,经反复循环,使靶DNA片段指数性扩增。图1给出了PCR扩增过程。
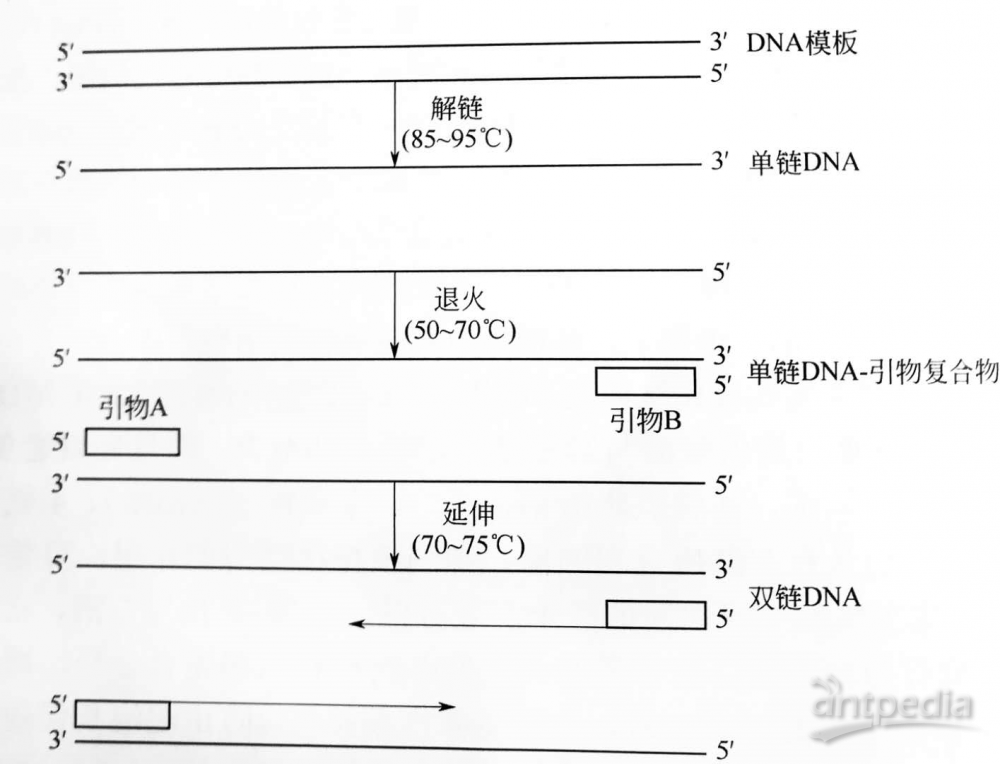
图1 PCR扩增过程
五、样品的浓缩、干燥及保存
1.样品的浓缩
生物大分子在制备过程中由于过柱纯化而使样品变得很稀,为保存和鉴定的目的,往往需要进行浓缩。表5列出了常用的浓缩方法及其适用范围。
浓缩方法 | 原理 | 适用范围 |
减压加温蒸发浓缩 | 降低液面压力-液体沸点降低-蒸发速度加快 | 不耐热的生物大分子的浓缩 |
空气流动蒸发浓缩 | 空气流动加速液体蒸发 | 少量溶液浓缩 |
冰冻法 | 溶液结冰后盐类及生物大分子保留在液相 | 耐低温生物大分子浓缩 |
吸收法 | 吸收剂直接吸收 | 不与吸收反应的生物大分子浓缩 |
超滤法 | 特殊薄膜对各种溶质分子进行选择性过滤 | 蛋白质和酶最适合的浓缩方法 |
表5 样品的浓缩方法及适用范围
2.样品的干燥
生物大分子的制备得到所需的产品后,为了防止其变质及易于保存和运输,常常要干燥处理,最常用的是真空干燥和冷冻干燥。
(1)真空干燥 真空干燥适用于不耐高温易氧化物质的干燥和保存,真空度越高,蒸发越快。
(2)冷冻真空干燥 又称升华干燥。除利用真空干燥原理外,同时增加了温度因素。在相同压力下,水蒸气压力随温度的下降而下降,故在低温低压下,冰很容易升华为气体。此法干燥后的产品具有疏松、溶解度好、保持天然结构等优点,适用于各种生物大分子的干燥保存。
3.样品的保存
保存方法与生物大分子稳定性及保持生物活性的关系很大。对生物大分子的保存可分为干粉和液态两种。
(1)干粉保存 干燥的制品一般比较稳定,储藏方法也很简单,只将干燥后的样品置于内装干燥剂的干燥器内密封,在0~4℃的冰箱保存即可。
(2)液态保存 液态保存只在一些特殊情况下采用,并需要严格的防腐保护措施,保存时间不宜过长。蛋白质和酶常用的稳定剂有硫酸铵、蔗糖、甘油等,液态核酸可保存在缓冲液中。




















