Cell Stem Cell:抗艾滋病药竟成治疗阿尔兹海默症潜在良方
淀粉样β(Aβ)斑块和大脑中tau蛋白的缠结积累是阿尔茨海默病(AD)的特征。许多研究都集中在前者,通过许多尝试来阻止、减缓甚至逆转Aβ的存在,从而改善AD的病情发展。到目前为止,结果喜忧参半。
一篇新的研究,发表在Cell Stem Cell杂志上,加州大学圣地亚哥医学院的研究人员荷兰的同事们合作,专注于替代治疗目标:tau。
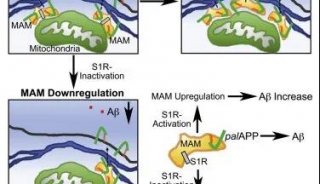
利用AD患者的诱导多能干细胞(iPSc)来源的神经元,研究表明胆固醇酯(CE)——细胞内过剩的胆固醇储存物——能成为tau的调节物。重要的是,通过对1600多种食品和药物管理局批准的药物进行筛选,他们发现低剂量的抗艾滋病药物efavirenz通过激活神经元酶“CYP46A1”降低了CE,从而降低了AD患者神经元中的tau。
iPSc来源于皮肤细胞,这些细胞被重新编程回到胚胎样多能干状态,然后被诱导分化为一种特定类型的细胞,在该研究中分化出的是神经元。
“我们的研究结果表明,CE对tau起作用,这意味着更多的选择和新治疗干预的可能性,”该文章的通讯作者,细胞和分子医学系杰出教授和桑福德再生医学联合会科学主任, Lawrence S.B. Goldstein博士说。“鉴定出CYP46A1-CE-tau途径意味着我们有一个药物靶点,并且在早期的AD中有一个潜在的治疗途径。”
AD的病因尚不完全清楚或了解,涉及遗传学和环境因素。有证据表明,易患AD的原因可能是胆固醇代谢改变,胆固醇代谢是人类大脑的主要组成部分。虽然大脑仅占人体总体重的2%,但它含有人体胆固醇的20%。胆固醇是细胞结构和功能的重要组成部分。
当大脑中健康的胆固醇代谢发生改变时,会产生一些后果,其中包括调节tau的CE的累积。tau的积累和聚集与AD的发展密切相关。在健康的脑细胞中,tau蛋白有助于形成微管,作为运输营养物质所需的分子通道。在AD患者的大脑中,tau蛋白形成称为神经纤维缠结的异常聚集物,导致神经元功能紊乱并死亡。
研究人员还证实了先前的报道,降低CE可防止淀粉样蛋白的形成。淀粉样蛋白前体蛋白(APP)在大脑中高水平产生,用于多种神经功能。Aβ斑块含有大量异常的APP片段。在一个健康的大脑中,这些片段被分解和消除。在AD患者大脑中,它们积聚成不溶性斑块,被认为是导致神经元功能紊乱和死亡的原因。
预防或消除Aβ斑块的积累,特别是在AD发展的早期阶段,一直是大量科学研究和大量药物试验的重点,但这些努力尚未产生有效和批准的AD治疗方法。目前,唯一批准的治疗AD的方法是管理行为症状,但不能减缓或延缓疾病的进展。目前还没有治愈方法。
在这项新的研究中,Goldstein与两位第一作者,Goldstein实验室的博士研究生Vanessa Langness,以及阿姆斯特丹维里耶大学的资深科学家、Goldstein实验室的前博士后Rik van der Kant博士,共同完成了这项研究。他们使用来自AD患者的iPSc分化成神经元建立疾病的细胞模型,包括家族型和零星型。他们发现CE在Aβ和tau的上游,因此提供了一个可以同时阻止两种蛋白质异常积聚的靶点。
此外,他们发现,即使在没有Aβ的情况下,CE也能促进tau的形成,这表明仅仅从大脑中移除Aβ(许多药物开发工作的目标)并不足以阻止疾病的发生。
多个AD研究者先前的研究表明,他汀(statins)类降胆固醇药物可能降低AD发病率,但其潜在机制仍存在争议。作者指出,他们的数据表明,如果要将他汀类药物作为治疗AD的候选药物使用,可能需要进一步完善,因为大脑中某些statins类药物要达到治疗的浓度时可能会导致脱靶效应。他们说,进一步研究statins类药物和efavirenz药物对于了解它们是否为治疗AD提供有用的方法至关重要。
-
综述

-
科技前沿
-
科技前沿