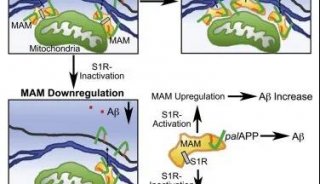
内溶酶体Aβ浓度和pH值是引起阿尔茨海默病的重要因素
Aβ淀粉样原纤维是具有规则交叉β结构的高度稳定的蛋白质聚集物,是阿尔茨海默病(AD)患者大脑中老年斑的主要成分。虽然淀粉样原纤维有毒性作用,但亚稳态的Aβ低聚体被认为是AD的主要毒性物质。在足够高的单体浓度下,Aβ很容易形成分子量为>50 kDa的球形、曲线型和环形低聚体,其中拉长的结构出现了球形低聚体的“串珠”式组合。淀粉样蛋白-β肽(Aβ)形成的亚稳态低聚体>50 kDa,称为AβOs,比Aβ淀粉样蛋白原纤维更易触发阿尔茨海默病相关过程,如突触功能障碍和Tau病理,包括Tau定位错误。在神经元中,Aβ在低pH的溶酶体内囊泡中聚集。在本研究中,研究人员具体分析了内溶酶体Aβ浓度和pH值对Aβ低聚体的形成及Tau错分类的影响。
研究人员从细胞外pH降低到溶酶体内pH时,发现AβO的组装速度加快了8000倍,但同时形成了淀粉样纤维。pH诱导AβO的形成和高溶酶体Aβ浓度共同使Aβ42在生理条件下广泛形成AβO。
为了测试dimAβ AβOs产生的生物学效应,研究人员分析了它们与树突棘的结合过程、直接细胞毒性、诱导Tau错分类的能力,以及对神经元功能的影响。在中性pH下,ThT监测的dimAβ的组装动力学显示了在浓度(COC)~1.5μM以上的双相行为,第一相对应于AβOs的无延迟齐聚,第二相反映淀粉样原纤维的形成。另外,Tau错分随时间的增加,说明dimAβ AβOs具有显着的动力学稳定性和持续性,和诱导病理性Tau错分的能力。通过测量神经元培养过程中的自发钙振荡行为,发现dimAβ AβOs处理24 h后钙振荡显着降低,表明dimAβ AβOs损害了神经元的活性和功能。研究人员证明了AβO靶向树突状棘,有效诱导Tau错分类(Tau病的关键因素)以及神经元活动损伤。
此外,研究人员发现,Aβ42和dimAβ均在溶酶体内腔室中积累,且内溶酶体pH促进AβO组装,但延迟淀粉样原纤维的形成。Aβ42在溶酶体条件下可以进行AβO组装。这些结果表明,内体/溶酶体系统是病理机制相关AβOs的主要组装位点。
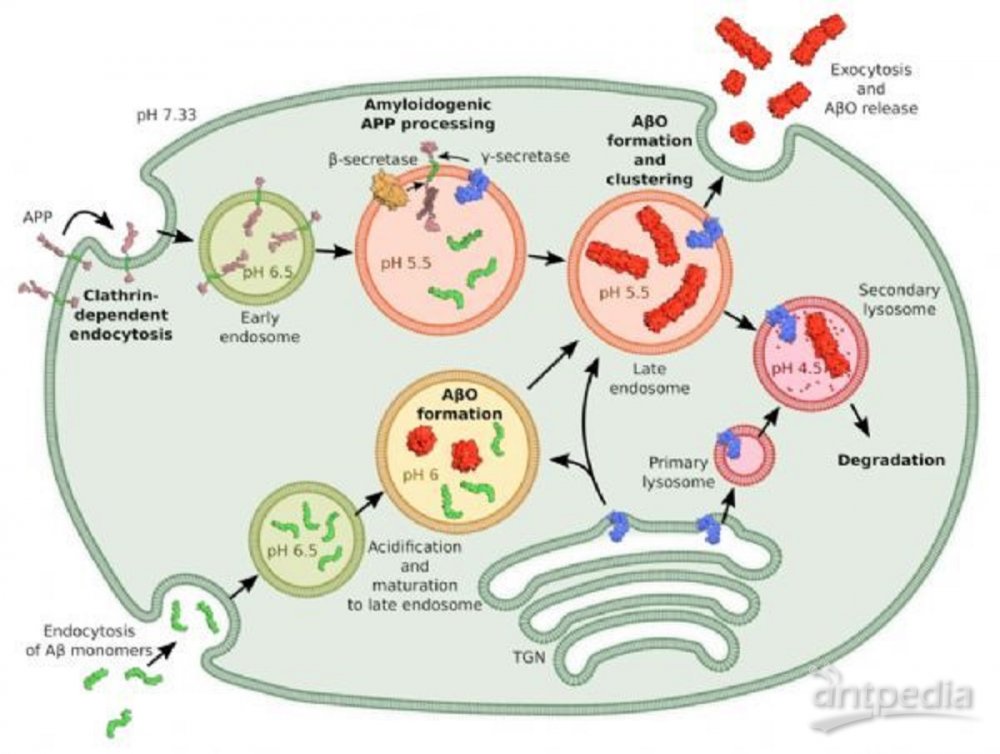
图 细胞内APP加工、Aβ摄取和AβO形成的方案
总之,研究人员应用dimAβ和Aβ42测试pH值从中性到内溶酶体pH值的降低是否影响AβO的形成。内溶酶体pH可加速AβO的形成,延迟淀粉样纤维的形成,表明AβO的形成是内溶体/溶酶体的主要聚集过程。研究进一步证明了dimAβ AβO是致病AβO形成的疾病相关模型,通过证明dimAβ AβOs靶向树突状棘,诱导阿尔茨海默氏病样体树突状Tau错选,并减少终末成熟的初级神经元突触传递。表明二甲基β衍生低聚物适合于阿尔茨海默氏病进展的下游机制和神经病理事件的研究。
参考文献:Schützmann, M.P., Hasecke, F., Bachmann, S. et al. Endo-lysosomal Aβ concentration and pH trigger formation of Aβ oligomers that potently induce Tau missorting. Nat Commun 12, 4634 (2021). https://doi.org/10.1038/s41467-021-24900-4