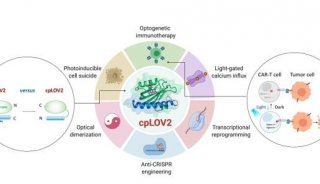
生命“光开关”,1秒光照,可达150倍以上基因表达效果
照射一束光,就能治好病?
这似乎是《西游记》等神话传说才会出现的情节。但是,华东师范大学生命科学学院副院长叶海峰团队,采用光遗传学的治疗手段,让这一设想成为可能[1]。

叶海峰(来源:叶海峰)
近些年,通过挖掘和设计光敏蛋白,科学家们构建出诸多光遗传学工具,并已用于肿瘤和代谢疾病治疗等领域。尽管光遗传学工具已有所发展,但要让一束光来治病,仍要攻克许多难题。
真正完美、且能用于临床应用的光遗传学工具,起码具备如下特征:
1、这种光能响应红光或远红光,具备较好的组织穿透能力,此外还得近乎 0 光毒性,并具备不错的体内应用潜能;
2、系统元件必须足够小,从而可被安全性较好的腺相关病毒包装递送,并能广泛用于基因治疗和基础医学研究;
3、必须灵敏度高,具体体现在光响应速度快,且能被随时关闭,此外还要具备较好的可逆性,可根据实际需要和应用场景做出灵活调节。
但是,此前并不存在可同时满足上述条件的光遗传学工具,这导致生物医学领域内的光遗传学应用,始终未能大范围普及。
比如,2017 年叶海峰课题组也曾出现一款红光系统,最快也得光照两个小时,才能诱导出足够的胰岛素表达量起到降血糖作用。
另据悉,相比蓝光和紫外光来说,远红光的好处在于,具有较强的组织透性。如果采用蓝光或紫外光,组织透性会很低,这时就很难完成小鼠体内的基因功能研究。
许多实验都需要基因敲除术,如果敲除掉某些致死基因,就会导致动物死亡,如此就无法进行相关基因功能研究。但是通过光控基因重组工具,就能以空间特异性的方式敲除靶基因,进而去研究基因的功能。
基于此,叶海峰团队不禁自问,是否可以开发用于操控生命的光遗传学工具?
答案是肯定的,经过重重努力,他和团队研发出这款完全符合上述要求的光遗传学工具 REDMAP。
它具有灵敏度高、响应红光激活、模块小、远红光关闭等优点,不仅能操纵细胞基因表达,还能用于糖尿病治疗、细胞信号通路的控制、基因编辑等多领域。相比此前同类系统,这款系统更强大,只需几分钟的光诱导,即可起到降血糖作用。

REDMAP 系统原理(来源:Nature Biotechnology)
开发用于操控生命的光遗传学工具
10月4日,相关论文以《一种用于哺乳动物应用的小而高度敏感的红/远红光遗传开关》(A small and highly sensitive red/far-redoptogenetic switch for applications in mammals)为题,发表在 Nature Biotechnology 上。该团队的两位博士生周阳和孔德强担任共同第一作者,叶海峰担任通讯作者。

相关论文(来源:Nature Biotechnology)
研究中,该团队关注到一种植物拟南芥,别名鼠耳芥、阿拉伯草等。它的光敏蛋白PhyA(phytochrome A)在红光(660nm)照射下,能和伴侣蛋白FHY1(far-red elongated hypocotyl 1)形成二聚体,进而能在远红光(730nm)照射下解离。
具体来说在黑暗状态下,光敏结构域 ΔPhyA-Gal4 存在于细胞质中。依靠光敏色素 PCB 的帮助,ΔPhyA-Gal4 能感受到 660nm 红光的外界信号,相关构像也可得到改变。
这时结合光依赖的转录激活子 FHY1-VP64,再将其转移到细胞核内,然后结合到其特异性识别的启动子,即可启动基因的转录翻译。在接受 730nm 远红光照射后,ΔPhyA 又恢复成原来的静默状态,并会和 FHY1 分开,从而终止基因表达。
基于这一特点,叶海峰等人设计出基于 PhyA-FHY1 的转录激活系统,然后将 PhyA 与 GAL4 的 DNA 结合域融合表达,再将 FHY1 和转录激活因子 VP64 融合表达。
这时,他们发现在红光刺激下,PhyA-GAL4 和 FHY1-VP64 可以结合并形成复合体,随后即可招募RNA聚合酶,借此即可启动下游基因的表达。
不过在一开始,完整的 PhyA 并没有激活下游基因的表达。为此,该团队做了相关工程改造,借助优化激活子和伴侣蛋白,终于研发出一款小模块、高灵敏度的光遗传学工具,由于它能响应红光,因此被命名为 REDMAP。据了解,这也是一种利用光来控制细胞信号通路的方法,可给基础研究提供便捷可控的方法。

REDMAPSOS-Ras 原理(左)及 REDMAPCas 原理(右)(来源:Nature Biotechnology)
研究中,该团队把 ΔPhyA 定位到细胞膜上,并将 FHY1 和 SOS 蛋白的激活域 SOScat 融合表达,然后用红光照射来控制 SOScat 的细胞定位,从而实现了 Ras/MAPK 信号通路的激活和去激活,最终构建出 REDMAPSOS-Ras 这样一款工具。
另据悉,叶海峰和团队还构建出 REDMAPCas 工具,并把 REDMAP 系统与基因编辑工具 CRISPR-dCas9 相结合,借此可高效调控哺乳动物细胞、小鼠肝脏及肌肉内源基因转录。
针对 REDMAP 系统在基因治疗领域的能力,他们也做了探索。由于截短的 ΔPhyA 蛋白的尺寸较小,因此可用腺相关病毒包装。研究中,该团队把 REDMAP 包装至腺相关病毒(AAV2/8)中,并将其注射至小鼠体内,实现了三个月以上的光控基因表达。
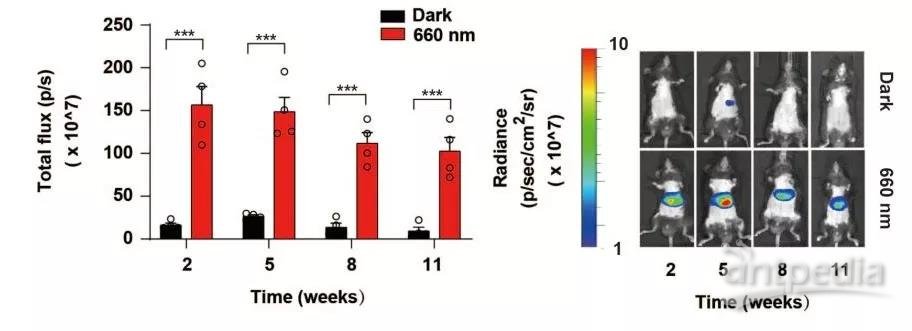
REDMAP 介导的小鼠体内长期基因控制(来源:Nature Biotechnology)
1 秒钟红光照射,可达 150 倍以上的基因表达效果
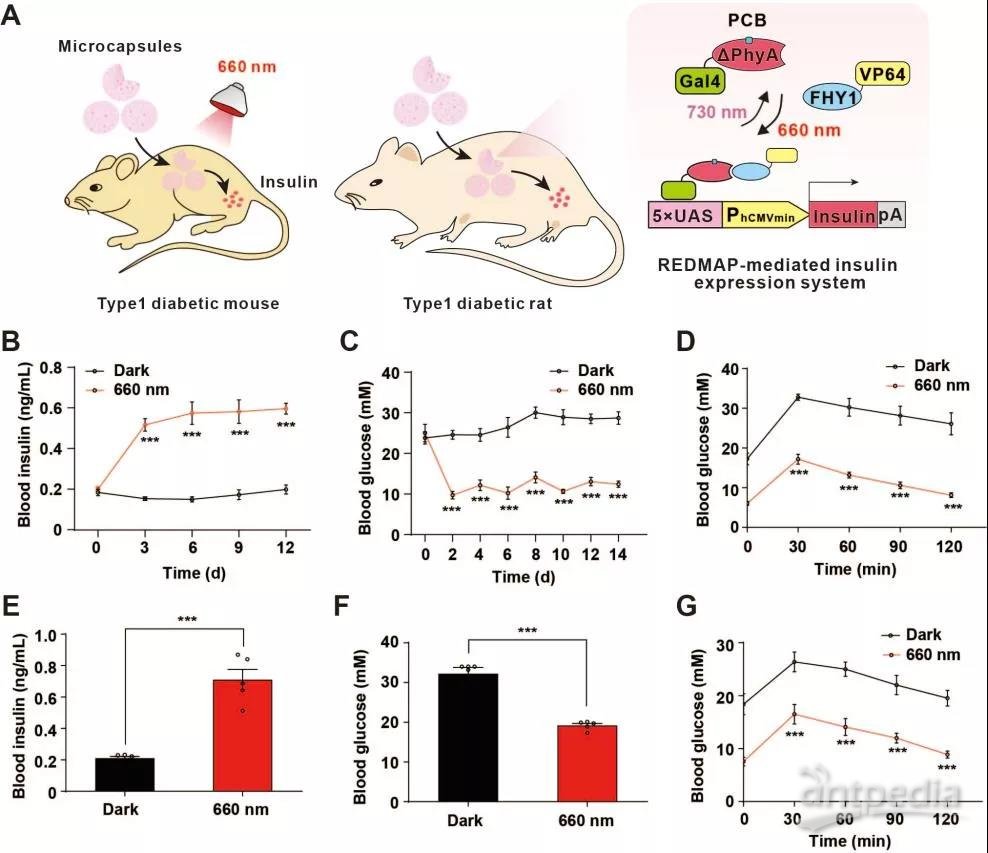
精准地控制治疗蛋白,对疾病治疗有着重要意义。为此,叶海峰等人将装载 REDMAP 系统的工程化细胞,移植到小鼠、大鼠和兔的皮下,借此探究该系统光响应能力。
结果显示,在 1-5 分钟短时间的光照内,就能诱导报告基因的高效表达。具来来说,在小鼠体内光照 1 分钟,在大鼠或兔子体内光照 5 分钟,就能让系统表达足够量的胰岛素。
随后,再对小鼠和大鼠体内胰岛素的表达进行光的精准控制,从而糖尿病小鼠和大鼠血糖稳态得以控制。

REDMAP 光照小鼠、大鼠、兔示意图(来源:Nature Biotechnology)
这意味着,受试动物无需每天定时服用药物或注射胰岛素,只需每天光照几分钟,即可实现显著降血糖的效果,这说明在精准可控的细胞治疗领域,REDMAP 系统的应用潜能极高。
总而言之,该 REDMAP 系统具有四大优点:
第一,超高灵敏度,只需要光照一秒钟便可诱导至少 150 倍的基因表达。
第二,超高可控性,可通过红光、远红光照射快速激活或关闭光控系统,分别在小鼠、大鼠、兔中实现高效光控基因表达。
第三,高度严谨性,光和色素小分子构成与门逻辑关系实现更严谨的双重控制。
第四,光控模块小。可通过腺相关病毒递送,在小鼠体内实现了长达三个月以上的基因表达控制。
在临床应用上的长远计划,叶海峰认为,通过光快速控制治疗药物的精准输出在代谢和肿瘤疾病的精准可控治疗中具有重要意义。
REDMAP 的动力学表征(来源:Nature Biotechnology)
值得注意的是,该系统还有望用于其他疗法,例如 CAR-T 肿瘤免疫治疗的精准控制,即通过光来控制 CAR-T 细胞的活性。
它也可用于调控任何有治疗价值的基因编码蛋白类药物,例如各种酶类、激素类、抗体类、各种细胞因子等,从而让 REDMAP 成为一个“光控细胞药物工厂”,进而对细胞药物进行时空精准控制。
通过皮下移植方法,每天只需要几秒钟或几分钟光照时间,即可让活体细胞药物工厂释放治疗药物。
概括来说,叶海峰等人开发出一款小模块、高灵敏度、可逆性良好的光遗传学工具,给基础医学研究和转化医学研究,特别是给精准可控的基因治疗和细胞治疗领域,带来了一款强有力的新型控制系统。

未来,该团队将聚焦光控基因编辑、光控基因重组、光控细胞治疗等方向继续深入研究。
参考:
[1].Zhou, Y., Kong, D., Wang, X. et al. A small and highly sensitive red/far-red optogenetic switch for applications in mammals. Nat Biotechnol (2021).https://doi.org/10.1038/s41587-021-01036-w