氧电极Nature发文光合碳同化关键酶Rubisco相变机制重要...
氧电极Nature发文光合碳同化关键酶Rubisco相变机制重要突破

**23 January 2019;DOI:https://doi.org/10.1038/s41586-019-0880-5**
核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)是光合作用碳同化关键酶,在藻类、植物以及部分光合细菌中保守存在。Rubisco是植物叶片中含量最丰富的蛋白质,也是地球上含量最多的蛋白质。Rubisco固碳效率非常低,是光合作用的限速酶,而藻类和少数植物可以利用二氧化碳浓缩机制(CO2-concentrating mechanism, CCM)以提高碳同化效率。
蓝细菌的α-和β-羧酶体含有由八个大亚基(RbcL)和八个小亚基(RbcS)组成的Rubisco以及碳酸酐酶复合物。由于HCO3-可以通过扩散进入羧酶体外壳而CO2不能,碳酸酐酶复合物因此可以产生高浓度的CO2用于Rubisco的碳固定。羧酶体外壳还可以防止还原剂进入,产生并保持内部的氧化环境。β-羧酶体的形成涉及由CcmM蛋白介导的Rubisco聚集。

CcmM蛋白以两种形式存在:其一为M58,发现于细胞聚球蓝细菌中全长的CcmM,N端包含有碳酸酐酶样(carbonicanhydrase-like,CA)结构域,随后是三个通过柔性linker连接Rubisco小亚基样(Rubisco small subunit-like,SSUL)模块;另一种为M35缺乏碳酸酐酶样(CA)结构域(图2g)。一直以来,人们认为SSUL模块通过替换RbcS与Rubisco相互作用。但是,真实的情况和具体的分子机制并不清楚。

近期,德国马普生化所Manajit Hayer-Hartl课题组在Nature杂志在线发表了题为Rubiscocondensate formation by CcmM in β-carboxysome biogenesis的研究论文,报导了Rubisco-CcmM复合物结构,并且通过生理实验验证了Rubisco在β-羧酶体生物发生过程中由CcmM介导的相变过程的分子机制。

此前有文章报道细胞通过一些使酶区域化的机制,作为调节代谢途径和提高其效率的策略。近期研究的热点相变是这个区域化作用的一种突出体现。
在这篇文章中,Hayer-Hartl课题组的研究人员不仅重组了Rubisco-CcmM复合物,解析了它的结构,还观测到了Rubisco相变过程对于酶活的重要性。了解羧酶体的生物发生对于未来将二氧化碳浓缩机制引入植物中具有重要意义。
此前的推测是SSUL模块通过替换RbcS与Rubisco相互作用,而从解析的Rubisco-CcmM复合物结构来看,SSUL模块结合在RbcL二聚体之间靠近Rubisco的“赤道”区域,连接Rubisco分子并诱导相分离成液体状基质。
他们首先解析了蓝细菌中CcmM的SSUL1的晶体结构(图1a),SSUL1与此前报导的RbcS结构同源,但是序列不同源(图1b)。并且,此结构是氧化状态下的结构,可以看到Cys261和Cys279之间的二硫键。同时,他们也解析了还原状态下的SSUL1结构,除了没有二硫键,其他与氧化状态下一致。

图1. SSUL1的氧化状态晶体结构和M35介导的与Rubisco形成的网络结构。a:Se7924中CcmMD的氧化态SSUL1(旋转90°双视图);b:SSUL1(洋红)与Se6301的RbcS(绿色)形成的网络结构
通过生化实验,他们发现Rubisco和M35按一定比例混合会变浑浊,形成聚集网络,并且验证该复合物是有功能的。但同时也发现,不管是单独的SSUL,还是M13-1,M13-2或M13-3(图2g),都不能形成该网络。只有M24-1/2(SSUL1&SSUL2)组合才能介导Rubisco网络形成(图2h,i)。

图2. M58和M35的结构域截短组合和Rubisco-M35的结合&解离生化实验
接着他们发现Rubisco-M35的网络动态特性表明这些蛋白质经历了液-液相分离(LLPS)。通过荧光实验,将Rubisco和M35red按一定比例组合,可诱导分层成圆形荧光冷凝物,符合液滴的特征,确定是LLPS现象。与Rubisco在绿藻类淀粉核中的行为类似,在更具活力的氧化条件下,M35可将Rubisco浓缩成液体基质,与羧酶体中的状态一致。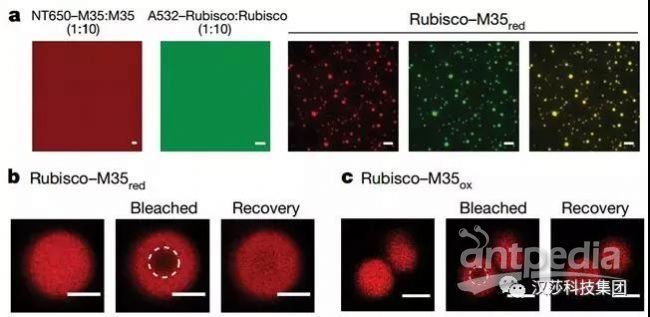
图3. Rubisco凝结成具有液体特性的网络
研究发现,在晶体结构中看到的SSUL中的二硫键对于羧酶体的生物学功能很重要,它增加了基质网络的灵活性,并且是体内羧基体功能所必需的。
通过使用Cholorolab2+液相氧电极(英国,Hansatech),评估野生型和突变型Se7942菌株对无机碳(Ci)的光合亲和力差异,评估其在Ci浓度范围内的O2释放速率。突变掉相关的Cys,将SSUL1或SSUL2中二硫键的破坏,会导致羧酶体对CO2的需求量增加约10至20倍,倍增的时间增加约2至2.5倍(图4)。

图4.二硫键在SSUL中的羧基功能作用。野生型Se7942和CcmM突变株对外部Ci的光合作用释放O2速率响应。使用经典Clark型氧电极(Cholorolab2+,Hansatech),通过从10μm到250mm Ci测定不同菌株Se7942对Ci依赖性放氧速率。半胱氨酸突变体(C279S、C395S和CcmM-4s)具有中等的需要CO2表型,而其中CcmM-4s具有最高的二氧化碳需求量。

为了解M35-Rubisco相互作用的分子基础,他们通过cryo-EM和单粒子分析解析到了复合物结构,在Rubisco“赤道”附近发现了额外的电子密度,通过结构修正,解析了完整的Rubisco–SSUL复合物结构(图5)。
结构显示4个SSUL模块结合一个Rubisco,与RbcL二聚体和RbcS之间的界面通过盐桥、范德华力等作用力互作。同时,他们发现SSUL与RbcS的互作对此前发现的Rubisco网络的形成非常重要。
图5. M35-Rubisco的Cryo-EM结构
因此,Rubisco的液体状缩合物的形成是通过与SSUL结构域的动态相互作用介导的,而不是通过低复杂性序列介导的,这与其它文献中的报道结果是一致的。




















