数字PCR在病毒临床检测中的应用
概述
2015年刚成历史,2016年已在眼前。就这样,年复一年间沧海成桑田。生命科学领域,新方法层出不穷,老方法不断升级,好不热闹。也如孔子的感叹:逝者如斯夫,不舍昼夜。
就拿PCR技术来说,荧光定量PCR作为一种进行基因表达分析的技术,截至目前最大的应用市场是病原微生物的核酸体外诊断。展望未来,作为qPCR升级版的数字PCR,最大的应用市场必然将转变成肿瘤相关的液态活检,对此陈斯卡坚信不疑。
那么,数字PCR在病原微生物的核酸体外诊断方面,是否仍然存在机会?是否在某些方面具有更出色的表现?对于《Lennette's Laboratory Diagnosis of Viral Infections第四版》的编辑Keith R. Jerome而言,答案是肯定的。2013年1月他就撰文,显然看好数字PCR在病毒检测中的应用前景,但2013年年初时,来自学术界一线的数据还较少,所以那篇综述可以理解为仅仅是他个人的看好。
一年后,在学术界源源不断的数据产出下,Keith R. Jerome(他任职于Fred Hutchinson Cancer Research Center的疫苗和传染病研究部门)结合自己的研究数据,于2014年5月撰文论述了数字PCR在病毒临床检测上的应用前景。本期,我们以他的观点为代表,阐述数字PCR在病原微生物(不仅限于病毒)核酸分析中的优势及应用的可能性。
qPCR面临的问题
虽然荧光定量PCR是目前病毒分子检测方面的“金标准”,具有广泛的应用,但由于对核酸分子的定量是依赖Ct值进行计算得到的,因此qPCR的最大瓶颈在于需要依赖于标准曲线。而构成标准曲线的标准品本身又缺乏统一的计量标准,因为标准品本身就是已知浓度或含量的样品。这两方面的因素造成了qPCR定量的结果在实验室内部与实验室之间的偏差(intra-和inter-laboratory imprecision),甚至不同实验室得到的结果是矛盾的。
数字PCR基于单分子层面的计数,可以彻底摆脱对标准品的依赖,解决由此而引起的结果重复性差的问题,大大提高检测结果的精度。
dPCR在精度方面的优势
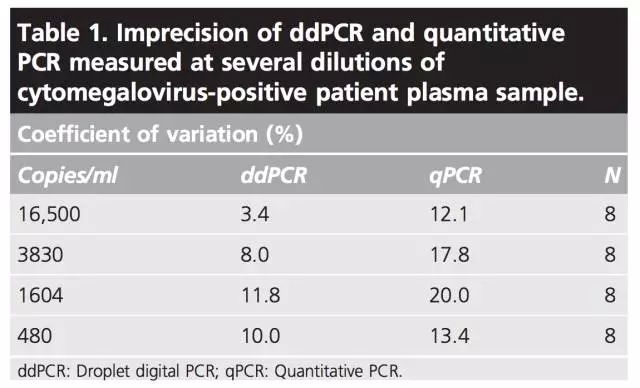
对于qPCR而言,尤其当病毒处于低丰度水平的情况下,检测结果的精度往往不理想。即使对于那些很有经验的实验室,有时结果的CV值(coefficient of variation)在20~30%之间,甚至更高。
截至目前,造成这种偏差的原因不明,对于CMV(巨细胞病毒)和HIV的研究表明,病毒载量的微小上升在临床上也具有显著意义。Waggoner对22例CMV感染患者的检测显示,病毒水平从200 copies/ml以下增加到200 copies/ml以上,患者就会出现明显的症状。这种情况下,检测结果的精度对于临床治疗尤其重要。精度越高,越能排除检测技术本身导至的偏差,结果越能反应患者在不同的检测时间(日或周)病毒水平的差异。如果病毒载量的对数差在50%以下, qPCR技术就不能实现有效区分。
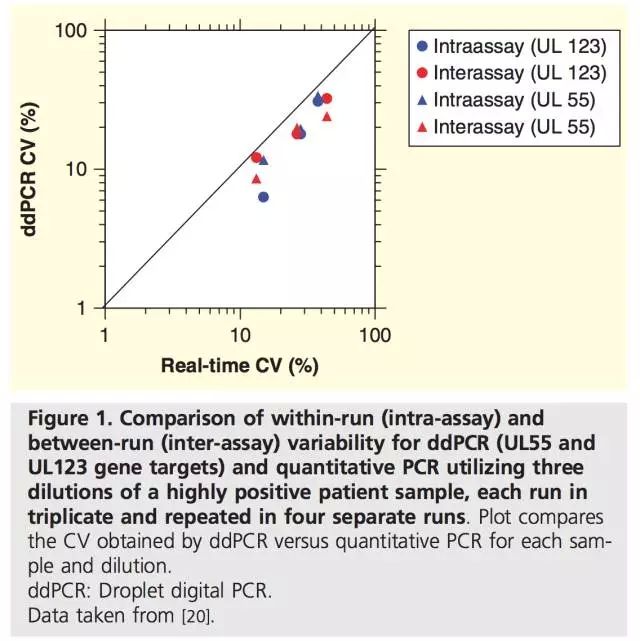
由于数字PCR绝对定量的特点,在相同TaqMan检测体系下,能显著降低结果的CV值。例如,Strain对150例HIV感染患者pol基因和2-LTR环状DNA的检测表明,pol基因ddPCR结果的CV值比qPCR下降了4倍,2-LTR环状DNA ddPCR结果的CV值下降了20倍(ddPCR和qPCR对每个样品进行3次平行检测)。即使对高水平CMV(大于10,000)的对比实验显示,ddPCR结果的CV值也低于qPCR。本综述作者所在实验室对不同浓度CMV的测试也得到相同的结论。
ddPCR对结果精度的提升还体现在“比例测试”的检测上,例如对以染色体重组整合方式存在的HHV-6(人类疱疹病毒6型)检测。人群中约1%的HHV-6病毒通过与人染色体着丝粒区域重组的方式存在,这种情况下qPCR不能区分HHV-6急性感染和ciHHV-6潜伏感染。ddPCR采用双重探针检测,可分别检测HHV-6的保守区域与宿主细胞的内参基因,最终通过HHV-6/cell的数值来判断患者是否是ciHHV-6潜伏感染。对经FISH验证的ciHHV-6感染患者淋巴细胞的检测发现,上述比值的平均值为0.96,SD值为0.03,CV值仅为3%。
dPCR可助力分子检测的标准化
qPCR进行病毒检测其结果在实验室之间可比性较差,究其原因在于“标准品”没有统一的标准。世界卫生组织(WHO)专门制备了“标准品”供全球的实验室使用,目前对“标准品”的定标采用对不同实验室的结果取平均得到。最近National Institute for Standards and Technology采用数字PCR的方法对CMV(SRM 2366)进行定标(CMV也是第一个采用数字PCR来进行定标的病毒),由于对该标准品给出了绝对的拷贝数,所以能用于实验室之间的校正、方法学的验证、不同assay结果的比较等等。
dPCR对抑制剂更高的耐受度
本综述作者专门设计了对比实验,系统比较了ddPCR和传统定量PCR对SDS、EDTA、Heparin(肝素,血液抗凝剂)等常见临床样品中PCR抑制物的耐受程度。通过比较两种平台的抑制曲线和最大抑制浓度中值(IC50)表明,ddPCR对SDS、肝素的耐受度高于荧光定量PCR。ddPCR的这一特性使得该技术尤其适合于复杂临床样品的检测,如粪便、痰液和组织样品等等。
为什么ddPCR能更加耐受PCR抑制剂的机制还处于进一步研究中,可能的原因有二:1,因为ddPCR在反应终点对荧光信号进行检测,所以对PCR扩增效率的要求大大降低,而荧光定量PCR则要求assay的扩增效率必须在90~110%之间;2,ddPCR的微滴化过程将PCR抑制剂排除在PCR反应液的水相环境之外,从而提高了对抑制剂的耐受度。
原文阅读
Tanis C. Dingle, Ruth Hall Sedlak, Linda Cook, Keith R. Jerome. Tolerance of Droplet-Digital PCR vs Real-Time Quantitative PCR to Inhibitory Substances. Clinical Chemistry 59:11 (2013)
dPCR目前存在的问题
数字PCR毕竟是一种比较新的技术,综述作者认为5年内还不可能取代荧光定量PCR方法大规模用于临床上对病毒的分子检测。
目前来看相较于qPCR,数字PCR的通量及单个样品检测的成本还不具优势。
数字PCR的自动化程度还不能和荧光定量PCR处于同一水平。
同样的条件下,数字PCR检测的线性范围不及荧光定量PCR。
相比于荧光定量PCR,在检测的灵敏度方面数字PCR并未表现出优势。(关于这点,已有很多研究显示出数字PCR在灵敏度上的优势,后续会专门就这个问题进行介绍)
dPCR的两种实现方式
目前已经面市的商业化数字PCR设备通过2种方式来实现:芯片式(以Life Technologies和Fluidigm为代表)和微滴式(以Bio-Rad和RainDance为代表)。从检测成本看,目前Bio-Rad的ddPCR最低。此外,Bio-Rad也已经实现了最大96个样品的自动化微滴制备和检测。
dPCR定位之陈斯卡观点
能够实现复杂来源样品中
极低含量核酸分子(DNA或RNA)
稳定检出的一种基于PCR的
绝对定量技术