诺奖风向标:WNT信号通路重要研究成果!
2019年9月24日科睿唯安发布了2019年的引文桂冠奖,迄今为止,已有50位“引文桂冠奖”得主获得诺贝尔奖,其中29位在获奖两年内即斩获诺奖,因此引文桂冠奖也成为名副其实的诺奖风向标。
来自荷兰乌得勒支大学的Hans Clevers教授就获得了2019年的“引文桂冠奖”,其因针对Wnt信号通路及其在干细胞和癌症中的作用研究,提供了一个新的药物测试的环境,可以在不使用细胞系或实验动物的情况下进行药物试验。本文中,小编就对近年来科学家们在WNT信号通路研究领域取得的重大成果进行整理,与大家一起学习!
图片来源:Nikolaos Doumpas et al.
【1】EBMO J:刷新认知!经典Wnt/β-catenin信号途径不依赖TCF/LEF也可调控靶基因表达
doi:10.15252/embj.201798873
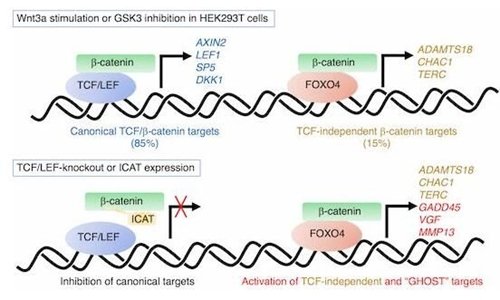
Wnt信号是一个进化保守的信号途径,在细胞增殖、细胞极性、细胞运动、分化、存活、自我更新和钙平衡方面发挥重要作用。经典Wnt信号是由β-catenin介导的Wnt信号途径,在没有Wnt信号的情况下,细胞内的β-catenin会被由Axin、APC、GSK3和CK1形成的降解复合体降解,Wnt配体能够抑制β-catenin的降解导致β-catenin在细胞核内积累与TCF/LEF家族转录因子形成复合体激活Wnt靶基因的转录。
之前一直认为对于经典Wnt信号途径来说,入核的β-catenin发挥活性主要由TCF/LEF家族转录因子所介导。但是来自瑞士的研究人员利用CRISPR/Cas9基因编辑方法构建了缺少TCF/LEF家族所有四个基因的HEK 293T细胞,发现β-catenin也可以不依赖TCF/LEF转录因子调节靶基因的转录。
【2】Development:经典Wnt信号通路参与骨骼肌发育影响成肌细胞融合
doi:10.1242/dev.168351
骨骼肌发育受到一系列有序调控途径的控制。Wnt/β-catenin是参与肌细胞发育的最重要信号途径之一,但是该信号途径对肌细胞生成过程的调控是否具有时空特异性还不清楚。最近来自美国的研究人员对上述问题进行了进一步探究,并将相关结果发表在国际学术期刊Development上。
在这项研究中,研究人员发现在表达Myog基因的成肌细胞中Wnt/β-catenin信号途径通过调节Nephrin基因的表达调控成肌细胞的融合过程。他们在表达Myog的成肌细胞中特异性敲除β-catenin基因,发现小鼠会出现成肌细胞融合过程的缺陷,但不会影响细胞的迁移和增殖。随后研究人员在Nephrin基因的启动子区域发现了保守的β-catenin结合元件,并且激活Wnt/β-catenin信号途径能够诱导Nephrin基因的表达。体外诱导敲除小鼠的成肌细胞,并进行Nephrin过表达能够重新恢复成肌细胞的融合过程,表明Nephrin参与Wnt/β-catenin依赖性的成肌细胞融合。
【3】Bone Res:华人科学家揭示经典Wnt信号途径介导YAP对骨稳态的调节
doi:10.1038/s41413-018-0018-7
对成年人来说,骨始终处在流失和重建的稳态平衡状态,一个关键的调控基因应该既能够促进骨生成又能抑制脂肪细胞的生成。YAP是受Hippo信号途径负调控的一个转录因子,众多研究已经证明Hippo/YAP是一个在多器官发育和大小调节方面非常保守的信号途径。但YAP在骨稳态维持方面的确切功能还存在争议。最近来自美国凯斯西储大学的华人科学家Wen-Cheng Xiong等人发现了YAP在调节骨稳态方面的新机制。相关研究结果发表在国际学术期刊Bone Research上。
在这项研究中,研究人员提出证据发现YAP存在促进骨生成并抑制脂肪生成的功能,因此能够维持骨稳态平衡。由于YAP在成骨细胞谱系中特异性表达,因此研究人员在小鼠的成骨细胞谱系中条件敲除YAP,发现YAP的缺失会抑制细胞增殖和成骨细胞分化,并增强脂肪细胞生成,导致骨小梁骨质流失。
【4】Science:新研究破解Wnt信号特异性之谜
doi:10.1126/science.aat1178
在一项新的研究中,在比利时布鲁塞尔自由大学研究员Benoit Vanhollebeke的领导下,研究人员解决了与Wnt信号特异性相关的一个重要的细胞信号转导谜团,相关研究结果发表在Science杂志上。
Wnt是一种古老的信号通路,它的进化似乎可追溯到多细胞动物的出现。它在细胞间通信中起着关键作用,并控制着胚胎发育和组织稳态的几个方面。当功能失调时,Wnt信号可能是许多疾病(特别是几种癌症)的起源。鉴于这个信号通路有10个受体和19个配体,而且这些受体和配体相互识别,因此这个信号通路的复杂性似乎是令人眼花缭乱的。脊椎动物细胞如何设法解释它们遇到的许多Wnt信号并触发足够强的反应?这种解释机制正是这些研究人员刚刚发现的。
【5】PNAS:研究发现促进经典Wnt信号受体复合体形成的重要分子
doi:10.1073/pnas.1721321115
Wnt/β-catenin信号能够控制发育、干细胞维持以及通过调节细胞增殖和命运决定影响成体组织的稳态平衡,该信号通路发生失调与癌症有很强的相关性。Wnt与细胞表面的受体Frizzled(FZD)和LRP6结合启动信号级联效应,引起Wnt靶基因的转录。
之前有研究表明在Wnt与受体结合后,Wnt受体会组装成称为信号小体的大型复合体,为与下游效应蛋白发生相互作用提供平台。但到目前为止这些信号小体的组装和调控过程还没有得到很好的了解,主要是缺少分析其组成成分的工具。
【6】Science:Wnt信号维持着少量2型肺泡细胞的干细胞身份
doi:10.1126/science.aam6603
作为肺部的呼吸单元,肺泡是由单层上皮细胞构成的微小的半球状囊泡。氧气通过肺泡进入血液循环。肺泡内壁上存在着两种类型的上皮细胞:鳞状1型肺泡细胞(AT1细胞)和骰状2型肺泡细胞(AT2细胞),其中AT1介导气体交换,AT2细胞分泌表面活性物质。不过,少量的AT2细胞可作为肺泡干细胞(alveolar stem cell)发挥功能。
在一项新的研究中,来自美国斯坦福大学医学院的研究人员发现在小鼠肺部的特定壁龛(niche, 也译作微环境)中分布的罕见AT2细胞亚群(下称肺泡干细胞)具有干细胞/祖细胞功能,它们在小鼠成年期间能够更新肺泡上皮。这些肺泡干细胞表达Wnt靶标基因Axin2,而且很多肺泡干细胞位于表达Wnt5a和其他的Wnt基因的单个成纤维细胞(作为肺泡干细胞的信号转导壁龛发挥作用,给肺泡干细胞提供Wnt信号)附近。肺泡干细胞发生间歇性分裂,能够自我更新,而且当它们离开这个壁龛时产生失去Wnt活性的AT1细胞。维持经典Wnt信号可阻断肺泡干细胞经分裂后产生的子细胞转分化为AT1细胞,然而缺失Wnt信号则会促进这种转分化。
【7】J Hepatol:AXIN失活突变诱导肝细胞癌并不依赖经典Wnt信号通路
doi:10.1016/j.jhep.2017.12.018
Wnt/β-catenin信号途径是肝细胞癌中最容易发生失调的信号途径。AXIN1是对Wnt/β-catenin信号途径进行负调控的一个重要调控因子,在大约10%的肝细胞癌中能够观察到AXIN1发生失活突变。全基因组研究通常将携带AXIN1突变和CTNNB1突变的肿瘤归为Wnt/β-catenin转录调控网络发生激活的一类,但是有研究表明因CTNNB1激活突变而发生的肿瘤在组织学特征、预后以及基因表达特征方面都与AXIN1失活突变的肿瘤存在不同。为了揭示CTNNB1突变、AXIN1突变和Wnt/β-catenin激活水平与肝细胞癌发生的关系,来自法国的研究人员进行了相关研究,并将研究结果发表在国际学术期刊Journal of Hepatology上。
在这项研究中,研究人员对两个独立的人类肝细胞癌数据集进行了β-catenin靶基因表达分析,还通过基因工程小鼠模型模拟Axin1失活引起的肿瘤发生过程并对肿瘤的基因表达进行了分析。研究人员根据基因表达情况将β-catenin靶基因的激活程度分为强、弱和非激活三种,分析结果表明超过80%的CTNNB1突变肿瘤存在β-catenin靶基因的强或者弱激活,而大多数AXIN1突变肿瘤(超过70%)属于非激活组。
【8】Nat Commun:新型WNT抑制剂有望清除癌症干细胞用于结直肠癌治疗
doi:10.1038/NCOMMS12586
近日,包括日本国家癌症中心在内的多家科研机构联合发表文章,宣布开发出一种叫做NCB-0846的小分子Wnt抑制剂。Wnt信号途径是癌症干细胞发育的一条关键途径,这种抑制剂的出现或为药物难治性结直肠癌病人提供新的治疗选择。
结直肠癌是导致癌症死亡的一个重要原因,全世界每年有大约70万人死于该病。超过90%的结直肠癌携带Wnt信号途径的体细胞突变,比如APC肿瘤抑制基因,导致Wnt信号途径的持续性激活。这反过来导致癌症干细胞的产生,癌症干细胞是肿瘤抵抗传统化疗的一个本质性因素。因此阻断Wnt信号途径的治疗方法可能是清除癌症干细胞治愈该疾病的关键。尽管已经获得了许多研发数据,但是至今仍然没有Wnt抑制药物可以用于临床实践。
【9】Nature: 肿瘤免疫治疗新靶点:Wnt/beta-catenin
doi:10.1038/nature14404
近日,一项刊登在国际杂志Nature上的研究报告中,来自芝加哥大学的研究人员通过研究发现,黑色素瘤细胞可以通过产生大量的beta-catenin,从而将它们自己与免疫系统的抗癌前线武器-T细胞屏蔽。他们还发现了,beta-catenin是如何阻止T细胞浸润到肿瘤细胞,从而减弱免疫治疗效果的。最后,研究人员们提出建议,该如何绕开这个障碍。
黑色素瘤的治疗在研发出了免疫疗法之后,有了革命性的改观。这些治疗策略包括阻断激活T细胞上的免疫抑制受体,例如,利用抗CTLA-4,PD-1和PD-L1的单 抗。然而,仅仅一部分的患者对这些治疗有效,他们常常是在治疗前,已经存在有T细胞的抗肿瘤反应,因为在肿瘤的微环境中可以检测到CD8T细胞的浸润。而没有T细胞浸润的黑色素瘤患者,常常是对免疫疗法抵抗耐药的。
【10】Stem Cell Rep:抑制Wnt路径可增强将成体细胞重编程为诱导多能干细胞的效率
doi:10.1016/j.stemcr.2014.04.001
近日,刊登在国际杂志Stem Cell Rep上的一篇研究论文中,来自巴塞罗那基因调控中心的研究人员通过研究为揭示细胞的重编程机理以及细胞重编程的效率又迈进了一步,研究者发现,Wnt信号路径在将成体细胞转化为诱导多能干细胞(ips)的过程中扮演着重要角色。
研究者Francesco Aulicino表示,一般来讲,转录因子可以增加或者降低细胞重编程的过程,这项研究中我们通过抑制Wnt信号路径增强了细胞重编程的效率;Wnt信号路径参与了细胞中一系列的生化反应,如果青蛙或者蜥蜴机体四肢受损,这些细胞中的生化反应就会促进其受损的四肢再生。尽管一般来讲人类和哺乳动物类并不具有机体再生的能力,但是Wnt信号路径在胚胎发育以及细胞融合过程中参与了许多反应过程。
-
焦点事件

-
焦点事件

-
焦点事件


















