Cell Research解析小鼠原肠期胚胎胚层形成的表观遗传规律
细胞命运决定过程的调控机制是哺乳动物胚胎发育研究领域关注的重点。在哺乳动物胚胎发育过程中,具有全能性的合子会依次经过桑椹胚期、囊胚期、原肠胚期等,最终形成能够发挥完整生物学功能的个体。其中,外、中、内三个胚层形成的原肠运动时期对后续胚胎发育蓝图的构建起着至关重要的作用。
表观遗传调控在哺乳早期胚胎发育过程中发挥着非常重要的调控作用。表观遗传调控的主要形式包括DNA甲基化、组蛋白修饰、染色质可接近性和染色质高级结构等。近年来,伴随着高通量测序技术的不断发展,多种适用于少量细胞起始的表观遗传学研究手段被开发出来。科学家们利用这些技术对哺乳动物的早期胚胎发育过程中多种表观遗传修饰的动态变化及其重要调控作用展开了深入研究【1-3】。
近期,景乃禾课题组利用时空转录组图谱技术对小鼠胚胎早期发育过程中的空间转录组进行了细致描述(详见此前BioArt的专题报道:专家点评Nature | 景乃禾/韩敬东/彭广敦等合作绘制小鼠早期胚胎发育全胚层谱系发生时空转录组图谱)【4】,充分揭示了早期胚胎发育过程中各胚层谱系的发育路径。然而对于胚胎发育过程中谱系形成的表观遗传调控规律的认识还不深入 。
在课题组前期研究中,研究人员利用少量细胞起始的DNA甲基化测序技术和少量细胞染色质免疫沉淀技术等,对小鼠胚胎早期发育过程中的DNA甲基化修饰和组蛋白H3K27me3修饰的动态变化规律,及其对胚外和胚内细胞命运特化的调控作用展开了深入研究(详见此前BioArt的报道:景乃禾、汤富酬合作团队揭示胚胎胚外发育基因沉默的差别表观遗传机制)【5】。然而,对小鼠胚胎原肠运动过程中更多表观遗传调控形式、复杂的染色质状态变化过程及其对胚层谱系分化的调控作用的认识还很欠缺。
2019年10月7日,中科院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所景乃禾课题组、北京大学生物医学前沿创新中心汤富酬课题组、中科院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所李劲松课题组与广州大学乔云波课题组共同合作在Cell Research 上在线发表了题为Distinct enhancer signatures in the mouse gastrula delineate progressive cell fate continuum during embryo development 的最新研究论文。该工作系统研究了小鼠原肠胚多种表观遗传修饰的变化规律,深入探索了各胚层命运决定过程中染色质状态转换的特异性规律,揭示了小鼠原肠胚中存在的大量特异性的具有潜在增强子活性的基因组区段(genomic bin),发现了大量器官发生关键基因的调控元件在原肠时期即被预标记的规律,同时验证了外胚层预标记增强子Ect2 在小鼠胚胎干细胞神经分化过程中的重要作用。这项工作为理解哺乳动物胚胎发育过程中细胞谱系的形成,及其发育潜能建立的表观遗传调控机制提供了大量翔实的数据,将极大地推动对哺乳动物早期胚胎发育过程规律及机制的认识,并对干细胞再生医学的发展提供重要理论支撑。

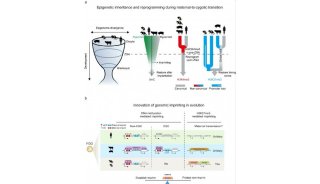
在该项工作中,景乃禾研究组及其合作团队首先结合原肠胚胚层细胞区域化分布特点和前期建立的少量细胞表观遗传学研究手段(low-cell number ChIP-seq和reduced representation bisulfite sequencing),对原肠运动过程中(起始阶段E6.5天,中间阶段E7.0天和结束阶段E7.5天)的表观遗传修饰(H3K4me1, H3K4me3, H3K9ac, H3K27me3, H3K27ac, DNA methylation)模式进行了系统性研究。通过结合ChromHMM 分析,研究人员构建了小鼠原肠胚中细胞的染色质状态模型。研究人员继而对启动子区域的染色质状态转换情况进行了分析,他们发现不同胚层的染色质状态转换呈现出不同的规律(图1)。其中,中内胚层细胞在原肠运动早期(E6.5-E7.0)就呈现出剧烈的染色质状态变化,而外胚层细胞在原肠运动晚期(E7.0-E7.5)才呈现出明显的变化。这一规律也表明原肠运动时期三胚层命运决定过程具有不同步性。

图1
研究人员还对原肠胚中具有潜在增强子调控活性的基因组区域进行了深入分析。他们发现这些具有潜在增强子活性的基因组区域的染色质状态变化同样体现出了不同步性(图2)。随后,研究人员利用已发表的着床前胚胎及器官发生时期胚胎的H3K27ac 修饰数据,构建了小鼠胚胎发育全过程的调控元件活性变化规律(图3)。研究人员确认了大量原肠胚中特异性存在的增强子。进一步分析发现,器官发生相关的关键基因邻近的增强子在原肠胚中即被预标记,而这些基因多数在器官形成时期才出现高水平的表达。研究人员进一步推测原肠胚中这些预标记的调控元件可能会在胚层谱系命运发育潜能 (developmental competence) 的建立过程中发挥重要作用。研究人员利用转基因增强子活性报告系统,对这些增强子在小鼠胚胎发育各阶段的活性进行了验证。研究人员还结合小鼠胚胎干细胞定向分化技术及基因编辑技术等,对数据中发现的一个在胚胎外胚层被特异性预标记的新增强子-Ect2的在体活性分布及功能进行了研究。他们发现该增强子在小鼠胚胎外胚层中具有特异性活性,并在小鼠胚胎干细胞神经命运决定过程中发挥着重要的调控作用。

图2

图3
综上所述,这项工作为理解哺乳动物胚胎发育过程中细胞谱系的形成,及其发育潜能建立的表观调控机制提供了大量翔实的数据,将极大地推动对哺乳动物早期胚胎发育过程规律及机制的认识,并对干细胞再生医学的发展提供重要理论支撑。
据悉,该研究由分子细胞科学卓越创新中心景乃禾研究员课题组、北京大学汤富酬教授课题组、分子细胞科学卓越创新中心李劲松研究员课题组和广州大学乔云波副教授团队共同合作完成。景乃禾课题组杨贤法博士、汤富酬课题组胡博强博士、李劲松课题组博士研究生廖娇阳和广州大学乔云波副教授为本文的共同第一作者,景乃禾研究员、汤富酬教授、李劲松研究员和乔云波副教授为论文共同通讯作者。该项工作还得到了英国皇家科学院院士、澳大利亚悉尼大学Patrick Tam教授、多伦多病孩医院Chi-chung Hui 教授、中科院生物物理所朱冰研究员、分子细胞科学卓越创新中心李党生研究员和周斌研究员等的大力帮助。该研究课题数据收集工作得到了生化与细胞所动物实验技术平台、分子生物学技术平台、细胞分析技术平台的大力支持。
原文链接:
https://www.nature.com/articles/s41422-019-0234-8
参考文献
1. Dahl, J. A. et al. Broad histone H3K4me3 domains in mouse oocytes modulate maternal-to-zygotic transition. Nature 537, 548-552 (2016).
2. Liu, X. et al. Distinct features of H3K4me3 and H3K27me3 chromatin domains in pre-implantation embryos. Nature 537, 558-562 (2016).
3. Xia, W. et al. Resetting histone modifications during human parental-to-zygotic transition. Science 365, 353-360 (2019).
4. Peng, G. et al. Molecular architecture of lineage allocation and tissue organization in early mouse embryo. Nature 572, 528-532 (2019).
5. Yang, X. et al. Silencing of developmental genes by H3K27me3 and DNA methylation reflects the discrepant plasticity of embryonic and extraembryonic lineages. Cell Res 28, 593-596 (2018).