揭示新的药物靶点:KRAS蛋白的构象控制位点
控制KRAS:揭示关键癌症蛋白的变构位点
研究人员在基因组调控中心和威康萨克研究所利用深度突变扫描技术全面识别了蛋白质KRAS中的变构控制位点,该蛋白质是许多类型的癌症中最常见的突变基因之一。科学家们使用深度突变扫描技术来量化超过26,000个突变对KRAS的折叠和其与六个相互作用伙伴结合的影响。
KRAS的变构控制位点代表着潜在的药物开发关键靶点,新的发现可能指出了可以利用来控制这一重要癌症原因的脆弱性。研究人员表示,他们的研究还呈现出了任何蛋白质的首个完整控制图。
研究团队的高级作者本·莱纳(Ben Lehner)博士在基因组调控中心和威康萨克研究所担任ICREA研究教授,他说:“医学领域的大挑战不是知道哪些蛋白质引起疾病,而是不知道如何控制它们。我们的研究代表了一种新的策略,可以针对这些蛋白质,加速药物的开发,以控制其活性。瞄准变构位点的性质意味着由此产生的药物可能比我们现在拥有的药物更安全、更有效。”
莱纳是该研究团队在自然杂志上发表的题为“KRAS抑制的能量和变构景观”的论文的高级作者。在他们的论文中,团队表示:“我们在这里首次呈现了任何蛋白质的抑制性变构位点的全球地图,以及突变对蛋白质与多个相互作用伙伴的自由结合能的影响的首个全面比较图谱。这个数据集包括了超过22,000个自由能测量,对于蛋白质生物物理学和计算生物学来说是一个丰富的资源。”
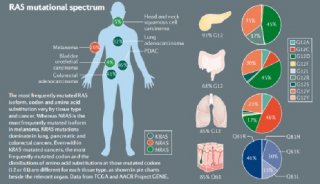
GTP酶KRas(KRAS)在人类癌症中突变率为10%,包括约90%的胰腺腺癌、约40%的结肠直肠腺癌和35%的肺腺癌,作者解释说。1982年发现,KRAS也被称为“死星”蛋白,因其球形形状和缺乏良好的靶点而闻名。因此,这种蛋白质一直被认为无法药物靶向。
控制KRAS的唯一有效策略是通过靶向其变构通信系统。作者进一步解释说:“KRAS作为一个原型分子开关,在不活动的GDP结合和活动的GTP结合状态之间循环。”KRAS在GTP结合时的构象和活性的改变是变构的一个例子,实际上是“在蛋白质中从一个位点传递信息到另一个位点的远程信息传递”。
KRAS的变构系统起到分子信号的作用,通过远程控制的锁和钥匙机制工作。要控制蛋白质,需要一把可以打开锁(活性位点)的钥匙(化学化合物或药物)。蛋白质也可以受到次要锁(变构位点)的影响,次要锁位于其表面的其他位置。当分子结合到变构位点时,它会导致蛋白质形状的改变,这可以改变蛋白质的活性或其与其他分子的结合能力,例如通过改变其主锁的内部结构来实现。
变构位点通常更适合药物开发,因为它们提供更高的特异性,减少了副作用的可能性。它们还可以更细微地改变蛋白质的活性,提供了调节其功能的潜力。与靶向活性位点的药物相比,靶向变构位点的药物通常更安全、更有效。
然而,变构位点非常难以捉摸。尽管有四十年的研究、数以万计的科学出版物和三百多个已发表的KRAS结构,但只有两种药物已经获得了临床批准——索托拉西布和阿达格拉西布。这些药物通过附着到活性位点旁边的一个口袋上,诱导蛋白质发生变构构象改变,从而防止其被激活。正如作者所评论的那样,“对于许多重要的医学蛋白质来说,开发针对KRAS的治疗方法受到了信息不足的限制,缺乏可以靶向的抑制性变构位点的信息。”

生成变构位点图谱的能力可以极大地加速药物开发,尤其是对于许多人类蛋白质来说,由于缺乏合适的活性位点或因其通过难以抑制的蛋白质-蛋白质相互作用界面而被认为是难以药物靶向的。然而,正如研究人员进一步指出的,任何致癌蛋白质、疾病靶点或任何物种的完整蛋白质的全面变构位点图谱都尚未生成。
对于他们新报告的研究,团队使用了深度突变扫描技术来绘制KRAS的变构位点。这涉及创建超过26,000种不同的KRAS蛋白质变体,每次仅更改一个或两个氨基酸。他们写道:“总共,这个文库包括了超过26,500个KRAS变体,包括超过3,200个单一氨基酸替代和超过23,300个双氨基酸替代。”团队检查了这些不同的KRAS变体与其他六种蛋白质的结合,其中包括对于KRAS引发癌症至关重要的蛋白质。他们首先专注于量化KRAS变体与致癌蛋白质效应子RAF1的结合,然后使用人工智能软件分析数据,检测变构并确定已知和新治疗靶点的位置。这一技术揭示了KRAS拥有比预期更多的强烈变构位点。这些位点的突变抑制了蛋白质与其所有三个主要伙伴的结合,这表明广泛抑制KRAS的活性是可能的。其中一些位点特别有趣,因为它们位于蛋白质表面的四个不同结构口袋中,容易访问,并代表未来药物的有希望的靶点。
研究人员强调其中一个口袋,“口袋3”,尤其有趣。他们承认,这个口袋远离了KRAS的活性位点,因此在治疗开发中之前几乎没有受到足够关注。“然而,我们的数据显示,口袋3是变构活性的,其中口袋3的6个残基的20个突变抑制了其与RAF1的结合。”
研究人员还发现,对KRAS进行微小的改变可以大幅改变其与伙伴的相互作用,使蛋白质更倾向于某一种伙伴而不是其他伙伴。这具有重要意义,因为它可以导致控制KRAS异常活性的新策略,而不会妨碍其在非癌细胞组织中的正常功能。保留正常版本的KRAS意味着副作用更少,治疗更安全、更有效。研究人员还可以利用这些知识进一步探讨KRAS在不同情景下的生物学行为,这可能是确定其在不同癌症类型中的作用的关键。
研究合著者、基因组调控中心的研究员André Faure博士进一步指出:“几十年来,因为缺乏大规模识别变构位点的工具,我们一直在寻找靶向药物位点。在这项研究中,我们展示了一种新方法,可以系统地为整个蛋白质绘制变构位点。从药物发现的角度来看,这就像打开了灯,揭示了我们可以控制蛋白质的多种方式。”
这项研究为任何物种中任何完整蛋白质的变构位点提供了首个完整地图。研究还表明,通过使用合适的工具和技术,可能会揭示出许多历来被认为是“难以药物靶向”的重要医学蛋白质的新的脆弱性。
研究团队指出:“在这里呈现的数据以及其他近期研究中的数据显示,变构位点比广泛认知的要普遍得多。”他们进一步表示:“而且,我们在这里应用于KRAS的方法相当通用,可以用来识别许多不同蛋白质中的变构位点。”研究人员认为,使用他们的通用策略将有可能系统地绘制出许多重要蛋白质中的调控位点。“绘制变构位点在药物开发中可能会起到越来越重要的作用,为治疗以前被认为是‘难以药物靶向’的蛋白质奠定了基础,”他们总结道。
该研究的第一作者,基因组调控中心的博士后研究员翁晨春解释说:“我们方法的独特之处在于其可扩展性。仅在这项工作中,我们进行了超过22,000次生物物理测量,与我们在利用DNA测序和合成方法方面取得的巨大进展之前所有蛋白质的测量数量相似。这是一次巨大的加速,展示了这种方法的潜力和威力。”
-
技术原理
-
焦点事件