细胞形态误诊为幼淋巴细胞白血病的慢性淋巴细胞白血...
细胞形态误诊为幼淋巴细胞白血病的慢性淋巴细胞白血病病例分析
细胞慢性淋巴增殖性疾病(B-CLPD)是一组成熟B淋巴细胞克隆性增殖累及骨髓与外周血的疾病,其中以慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)最为常见,大多数表现为惰性病程[B-幼淋巴细胞白血病(B-PLL)与套细胞淋巴瘤(MCL)除外][1]。B-CLPD组别中各类疾病的诊断与鉴别诊断在实际的临床工作中具有一定的难度,本文报道1例从细胞形态学角度被误诊为幼淋巴细胞白血病(PLL)的CLL。
1临床资料
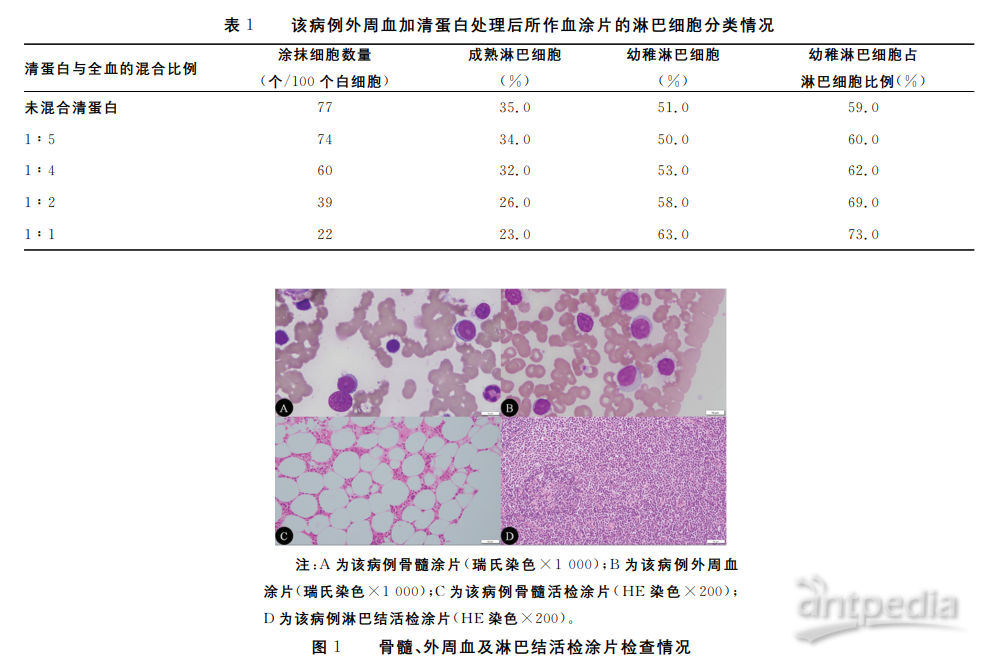
患者,男,64岁,因“腹股沟肿块肿大1月”,于2019年8月14日到本院就诊。门诊血常规检测:白细胞计数39.69×109/L,红细胞计数3.44×1012/L,血红蛋白109g/L,血小板计数142×109/L,仪器提示细胞分类异常,镜检可见淋巴细胞比例明显增高,可见一定比例的幼稚淋巴细胞。以“血象异常”收入本院血液科。体格检查示(仅阳性体征):体温36.6℃,脉搏93次/分,呼吸20次/分,血压144/80mmHg,双下肢皮肤多处皮疹、抓伤后破溃及散在出血点,颈部、腋下、腹股沟可触及浅表淋巴结肿大,脾肋下8cm,质硬。胸部CT平扫示:两肺上叶继发性肺结核,病灶以增殖钙化纤维灶为主;纵隔内及双侧腋窝多发肿大淋巴结;右肺上叶及下叶结节;少量心包积液;附见肝内多发低密度灶、脾大。浅表淋巴结超声示:双侧颈部、双侧锁骨上、颏下、双腋下、双腹股沟淋巴结肿大。腹部超声示:肝囊肿;慢性胆囊炎、胆囊结石;脾大;双肾囊肿;胰腺未见明显占位;腹腔多发实性结节,考虑肿大淋巴结可能。骨髓细胞形态学:骨髓增生明显活跃,髓片中淋巴细胞增生明显活跃占65.5%,其中幼稚淋巴细胞占45.0%,该类细胞胞体中等大小,核圆或类圆,染色质较疏松,大部分幼稚淋细胞可见清晰核仁,细胞质呈灰蓝色,涂抹细胞可见。外周血涂片中淋巴细胞比例相对增高,幼稚淋巴细胞占51.0%,其占淋巴细胞(幼稚+成熟)的比例为59.0%,形态与骨髓中相同,涂抹细胞易见。提示:淋巴细胞增殖性疾病(LPD)之骨髓象(PLL不能除外)。考虑到外周血涂片中大量的涂抹细胞可能会影响计数结果,尤其是幼稚淋巴细胞与成熟淋巴细胞的百分比,进而干扰了幼稚淋巴细胞在淋巴细胞中的占比,于是笔者结合实验室的实际情况采取了一些减少血涂片中涂抹细胞的措施(在外周血样本中加入不同比例0.2g/mL的清蛋白溶液),并重新进行了分类计数,结果见表1。
骨髓流式细胞免疫分型(2019年8月19日):CD34+细胞占有核细胞比例0.1%。在CD45/SSC点图上设门分析,淋巴细胞约占有核细胞的82.1%,其中CD45+CD19+细胞约占有核细胞的67.9%,表达HLA-DR、CD5、CD19、CD20dim、CD22dim、CD23,部分细胞表达CD200、sKappa,少数细胞表达CD11c、CD38,不表达CD10、CD25、CD103、FMC-7、Bcl-2,该群CD45+CD19+细胞符合慢性B淋巴细胞白血病(B-CLL/SLL)免疫表型。骨髓活检:骨髓组织中查见极少慢性淋巴细胞白血病成分。免疫组化:MPO(粒系+)、CD235α(红系+)、CD3(极少散在+)、CD20(极少散在+)、网染(-)、CD10(-)、CyclinD1(-)、CD23(极少+)、CD34(-)。淋巴结活检:考虑CLL/SLL。免疫组化:CD3(-)、CD4(-)、CD5(-)、CD8(-)、CD20(+)、CD79a(+)、Ki-67(+30%)、Bcl-2(+)、CD10(-)、MPO(-)、PAX-5(+)、CyclinD1(-)、SOX-11(-)、TdT(-)、CD23(+)、CD43(+)、CD68(-)、CD34(-)。注:A为该病例骨髓涂片(瑞氏染色×1000);B为该病例外周血涂片(瑞氏染色×1000);C为该病例骨髓活检涂片(HE染色×200);D为该病例淋巴结活检涂片(HE染色×200)。
骨髓细胞染色体检查:44,XY,add(4)(q12),-6,-13,-17,add(19)(p13),?der(22)t(13;22)(q14;p11.2),+mar[11]/46,XY[9]。免疫球蛋白重链可变区(IGHV)突变状态分析:检测到IGHV3-23的克隆性重排阳性,再行克隆性重排序列的体细胞超突变分析,突变率为0.43%。CLL相关21种基因突变分析:TP53基因上检测到c.523C>G(p.Arg175Gly)(突变频率48.5%,因标本问题未行胚系验证),杆状病毒IAP重复序列3基因上检测到移码突变c.1285dup(p.Glu429GlyfsTer9)(突变频率29.8%)。综合该病例的体征及检查结果,最终诊断为慢性淋巴细胞白血病伴幼淋巴细胞增多(CLL/PL),综合患者家属意愿后,原拟定予氟达拉滨+环磷酰胺方案化疗,因本院采购氟达拉滨失败,同患者家属沟通后,于2019年9月11日开始给予伊布替尼420mg口服治疗。经治疗后患者病情平稳,予出院。
2讨论
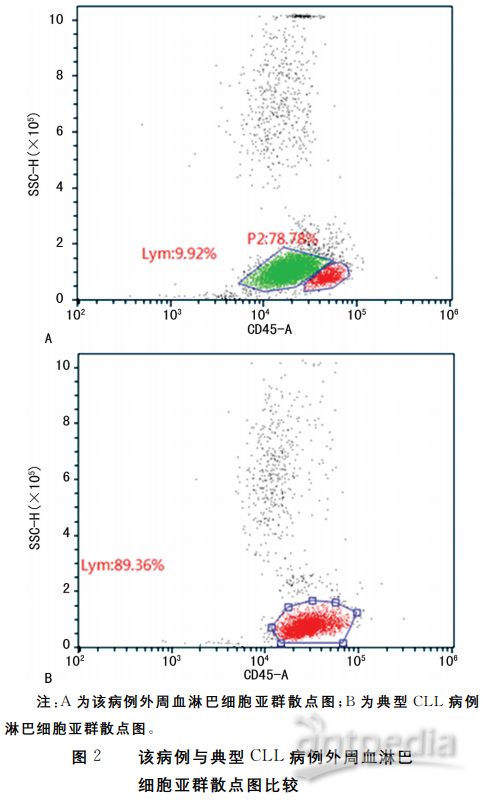
该病例在形态学上的主要特点为骨髓和外周血中有较高比例的幼稚淋巴细胞,分别占45%和51%,这些幼稚淋巴细胞呈中等大小,约为成熟淋巴细胞的1.5~2.0倍,细胞核为圆形或类圆形,染色质较为疏松,大部分可见一个明显的核仁位于核中央,细胞质量较多,呈灰蓝色。由于该病例外周血涂片中淋巴细胞中以幼稚淋巴细胞为主,且幼稚淋巴细胞的比例可达到59.0%~73.0%(表1),满足了PLL的诊断标准[2],即外周血幼稚淋巴细胞占淋巴细胞比例≥55%,而典型的CLL中所具有的不典型淋巴细胞及幼稚淋巴细胞<55%[3],因此,在形态学方面该病例PLL诊断初步成立。另外,在骨髓细胞免疫表型结果未得知之前(笔者单位仅从事细胞形态学检验,其余检测均外送第三方实验室),笔者对该患者的外周血进行了淋巴细胞亚群的检测,发现CD45和SSC的散点图上,在淋巴细胞群的左侧出现了一群相对独立的细胞(图2A),这样的呈现与典型CLL完全不一样(图2B),虽然这对于疾病的诊断没有帮助,但这种表现使得形态学工作者认为该病例更加倾向于非CLL的诊断。B-PLL与其他成熟B淋巴细胞白血病和淋巴瘤有相当多的重叠[4],尤其难以通过形态学和免疫表型与MCL相区分[5],因此需要结合其他检测进行鉴别诊断。该病例行染色体检查并未检出t(11;14)(q13;q32)异常,因此MCL可以排除,但由于B-PLL并无特异性的遗传学异常,因此仍需进一步结合免疫表型与其他B-CLPD相鉴别。由该病例骨髓细胞免疫表型结果可知,该病例表达人类白细胞抗原DR位点、CD5、CD19、CD20(dim)、CD22(dim)、CD23,部分细胞表达CD200、sKappa,而B-PLL的典型免疫表型[4]为:强表达表面IgM+/-IgD,Kappa或Lambda轻链和CD20,以及CD19、CD22、CD79a和FMC7阳性,CD5和CD23阳性相对少见,该病与B-PLL的表型不符,因此从免疫表型角度排除了B-PLL的诊断。根据英国马斯登皇家医院免疫标志积分可知[1],通常CLL为4~5分,其他B-CLPD为0~2分,而该病例积分为4分,且基本符合典型CLL的免疫表型[2]:CD19(+),CD5(+),CD23(+),CD200(+),CD10(-),FMC7(-),CD43(+);表面免疫球蛋白、CD20及CD79b弱表达(dim)。因此从免疫表型的角度将该疾病诊断为CLL。骨髓活检和淋巴结活检显示,免疫组化CyclinD1为阴性,排除了MCL,结合其他免疫组化的结果也同样支持CLL/SLL的诊断。
外周血淋巴细胞亚群散点图比较该病例可见染色体检查为复杂核型,且出现了大于5个染色体畸变,这在CLL方面意味着预后不利[6]。IGHV基因突变状态(以2%突变为判定标准)是判断CLL预后的独立指标,不具有IGHV基因突变的CLL患者预后明显差于具有突变的患者,而VH3-21片段的表达则是独立于IGHV基因突变状态的预后不良标志[7]。该病例IGHV基因突变状态为未突变,这说明肿瘤细胞可能来源于幼稚B细胞,而非记忆B细胞,因此在形态上也表现得更加幼稚与不典型[8]。遗传性的TP53基因突变与肿瘤的遗传易感性有关,该病例虽检出突变,但因标本原因未行胚系验证,未能证明其遗传性。TP53基因突变也是判断CLL预后的重要因素,与del(17p)具有同样的预后价值[9]。该病例诊断过程中最大的争议源自于形态学中PLL的诊断标准。自1974年首次报道PLL以来,直至今天,PLL在形态学上的诊断依然严格地遵循着“外周血幼稚淋巴细胞占淋巴细胞比例≥55%”这个标准。但该病例的出现却与此标准不相符合,同时也颠覆了形态学工作者面对类似病例时的诊断思路。希望该病例能够引起血液病学工作者的重视,进一步探索研究并完善B-CLPD的认识与鉴别。
参考文献略。