磷酸化位点分析实验-磷酸肽的分离
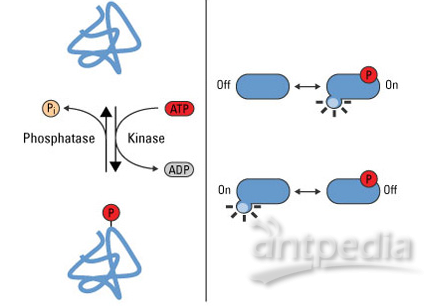
| 实验方法原理 | 磷酸化分析的原理研究的最常见的磷酸化类型是丝氨酸、苏氨酸和酪氨酸的磷酸酯化。已知发生的磷酸化还有精氨酸、组氨酸和赖氨酸的亚酰胺化,以及天冬氨酸和谷氨酸的酰化。这些修饰中的其中一些是化学不稳定的,通常观察不到,除非采取特殊的保护措施防止他们在蛋内质分离过程中消失。举例来说,组氨酸磷酸化是一个相对常见的修饰,至少在原核生物中是这样,但是,在聚丙烯酰胺凝胶常用的酸性染色条件下,磷酸化组氨酸完全消失。因此,在凝胶分离的蛋白质中通常观察不到磷酸化组氨酸,其在细胞中出现的频率也很难估计。 蛋白质磷酸化水平是由两个作用相反的酶系一一磷酸酶和激酶来调控的。这些酶中大部分的纳构、专一性、调控已被深入研究过。 据估计有几百种蛋白激酶/磷酸酶,它们有不同的底物、动力学特性、组织分布及其与调控通路的关系。通过对酿酒酵母全基因组 DNA 序列中被认为代表蛋白激酶(磷酸酶)的序列基元 (motif) 的分析表明、酵母能够表达 123 种不同的蛋白激酶 (40 种蛋白磷酸酶).这就暗示 2%的酵母蛋白参与了蛋白质磷酸化过程。了解蛋白质磷酸化对功能的影响可以深入理解生命系统如何在分子水平进行调控,例如,一个单一的磷酸化过程可以调节糖原磷酸化酶的活性。对蛋白质酪氨酸激酶 p561ck 的研究工作表明,在单个丝氨酸上的磷酸化[可能是由促分裂原活化蛋白 (MAP) 激酶所致], 能够改变一个酶的底物专一性。酪氨酸磷酸盐诱导的蛋白质相互作用已经表明其提供了稳定蛋白质复合物所需的支架,这种蛋白质复合物表现出复杂的生物功能,持别是在细胞间的信号传导过程中, 因此可以明显看出可逆的蛋白质磷酸化是一种非常重要的蛋白质修饰,它能改变酶的催化活性和底物的专一性,调节具有调控功能的蛋白质复合物的稳定性和亚细胞定位,从而扩展生物活性和功能。 |
|---|---|
| 实验材料 | |
| 仪器、耗材 | |
| 实验步骤 | 本质上,任何分析蛋白质磷酸化位点的方法都要依靠对所研究磷酸化蛋白质的纯化,用酶或化学方法水解磷蛋白,分离、分析产生的磷酸肽。幸运的是,前面部分所述的用于处理丙烯酰胺凝胶电泳分离蛋白质的方法同样适用于磷蛋白的分析。所以,用于产生磷酸肽样品的方法是:用凝胶电泳分离蛋白质,水解蛋白质条带或蛋白斑点,提取产生的磷酸肽混合物作进一步分析。虽然磷蛋白在 SDS-PAGE的迁移通常比其非磷酸化的蛋白慢,但是,在一维胶上着到两条迁移非常接近的条带.或在 2- DE 上观察到.系列有相同分子质量但不同等电点的斑点,这样的现象并不足以确定某一个蛋自是磷酸化蛋白。用32p 标记后放射自显影,或磷储屏分析 (storage phosphorimaging). 或用 Western 印迹方法鉴定磷蛋白的结果较为确定、可信。用现有的方法在常规实验中就可将32p放射标记物掺入体内或体外磷酸蛋白质中。分子放射标记方法用于体内磷酸化蛋白质标记,要标记的细胞或组织与32PO4孵育一段时间,使细胞 ATP 库与32p平衡。放射标记的 ATP 被蛋白激酶用于磷酸化其底物。体外蛋白质磷酸化的激酶反应用[γ-32p] ATP 作为放射标记物来源,粗分的细胞裂解液或纯化的激酶作为激酶活性来狠。 Western印迹在检测酪氨酸磷酸化蛋白方面特别成功,因为已经开发出一系列非常灵敏的酪氨酸磷酸盐特异性抗体, 同时也因为此方法没有放射性同位素标记,泛磷酸特异性抗体或磷酸-丝氨酸和磷酸-苏氨酸特异性抗体的开发还不太成功。
|
| 注意事项 | 细胞内的许多磷酸化蛋白的含量非常少.几乎不可见。即使蛋白质的表达量处于相对较高的水平,磷蛋白的分析也很困难,因为蛋白磷酸化的化学计量值常常很低,某一个蛋白质中仅有一少部分袚磷酸化,某一蛋白质中也会存在多种不同的磷酸化类型。由于这些原因,即使用当前最灵敏的分析方法,也很难分离到足够量用于分析的体内磷酸化蛋白质。因此许多蛋白质的磷酸化研究是在体外利用激酶反应使蛋白质被磷酸化修饰,通常能够扩大反应规模以产生大盘的磷酸化蛋白 。在体外研究确定的磷酸化位点被认为具有生物学意义之前,必须证实在体内存在相同的磷酸化位点。通常通过比较体内和体外的同一磷酸化蛋白质的二维磷酸肽图得知(图 5.S)。体外磷酸肽产生的量大,经化学或质谱分析作为金考证实体内微量磷酸肽的鉴定。当各自的磷酸肽在谱图中共迁移时则可认为体内、体外磷蛋白有相同的磷酸化位点。因此.这个方法通过与一个结构清楚的参考样品肽共迁移在某种程度上间接证实了一个体内磷酸化位点的确定。 |