遗传发育所在植物着丝粒研究中取得进展
染色体的精确分离是保证遗传信息正确传递和基因组稳定的前提,这个过程直接依赖着丝粒区组装的多层动粒蛋白复合体和纺锤体微管间的动态结合。目前,在哺乳动物和酵母中已鉴定超过100个动粒蛋白,它们之间相互结合形成蛋白亚复合体结构,包括与着丝粒染色质直接结合的内侧组成型CCAN蛋白网络、与微管直接结合的外侧KMN网络复合物、调控细胞周期进程的纺锤体组装检验点(SAC)等。动粒蛋白发生频繁的变异,并与其互作蛋白以多种形式协同进化,导致真核生物动粒组成产生复杂的多样性。例如,SAC信号组分Bub1/Mad3蛋白家族(BMF)在酵母和哺乳动物中有两个拷贝,而在植物中发生两次独立重复事件,产生三个拷贝(Bmf1/2/3),其祖先蛋白保守的结构域在三个拷贝之间随机重排和分配,相应蛋白的功能发生分化及新功能化。因此,在植物中对动粒蛋白组成及其生物学功能进行研究有助于阐明真核生物动粒复合体的复杂进化历程,有利于对理解染色体正确分离和取向的基础生物学过程提供不同认识。
中国科学院遗传与发育生物学研究所研究员韩方普课题组长期从事植物染色体生物学的研究。在前期工作中,课题组在玉米着丝粒中发现,激酶Bmf1介导组蛋白H2AThr133磷酸化和激酶Haspin介导组蛋白H3T3磷酸化在着丝粒区发生时空周期性的动态变化,通过磷酸化相应底物维持动粒和纺锤体微管的结合,调控染色体的正确取向和分离(Dong and Han, 2012. Plant J;Su et al., 2017. New Phytol;Liu et al., 2017. Plant J;Liu et al., 2020. J Exp Bot)。然而,这些激酶如何结合到动粒蛋白复合体上,或者说在动粒复合体上的受体是什么,在植物中一直没有相应的研究。前期关于其他物种的研究发现,Knl1作为动粒外侧较大的骨架蛋白之一,通过不同的氨基酸短基序协调不同蛋白之间的相互作用,介导其他动粒复合物的组装以及SAC信号的激活,如Mps1激酶磷酸化Knl1保守的MELT重复单元,招募Bub3-Bub1复合物定位到动粒,并促进Bub3-Mad3复合物的动粒定位。但由于Knl1蛋白具有复杂的进化历史,植物Knl1蛋白在细胞分裂过程中的作用及其如何调控动粒SAC信号途径尚不清楚。
该研究中,研究人员在玉米中首先克隆了动粒外侧Knl1基因,细胞遗传学的研究发现,Knl1作为动粒组成型蛋白,在有丝分裂和减数分裂过程持续定位在着丝粒区域;遗传学的功能分析表明,Knl1敲除突变体影响有丝分裂染色体在赤道板的排列和后期染色体的分离。这些结果表明,植物Knl1蛋白表现出相对保守的功能。然而,多序列比对和系统发育分析发现,Knl1蛋白在植物、真菌和哺乳动物中发生广泛的分化,而且单双子叶植物中Knl1蛋白也位于不同的分支。植物Knl1蛋白没有检测到保守的SILK、RWD和MELT等结构域,暗示植物SAC组分招募到动粒的机制可能发生变化。进一步的蛋白互作的实验发现,玉米Knl1蛋白只保留与BMF蛋白家族Bmf1/2的互作,失去了和Bmf3及Bub3的互作。一系列蛋白截断和突变实验证明,玉米Knl1蛋白中部一段145氨基酸可能和Bmf1/2的TPR结构域形成具有疏水界面的螺旋构象(尽管Bmf3也包含TPR结构域),而且这个区域在单双子叶植物中表现出明显的分化,暗示不同植物谱系SAC信号通路与动粒的结合存在不同模式。相关研究成果为动粒蛋白网络和SAC信号通路之间提供了一个协同进化的模式。
相关研究成果在线发表在PNAS(DOI:10.1073/pnas.2022357118)上,博士苏汉东(现为华中农业大学教授)和博士研究生刘阳、王春挥为论文的共同第一作者,韩方普为论文通讯作者。研究工作得到遗传发育所研究员周俭民课题组在酶活性检测方面的帮助,获得国家自然科学基金委重点国际合作研究项目及重点项目的支持。
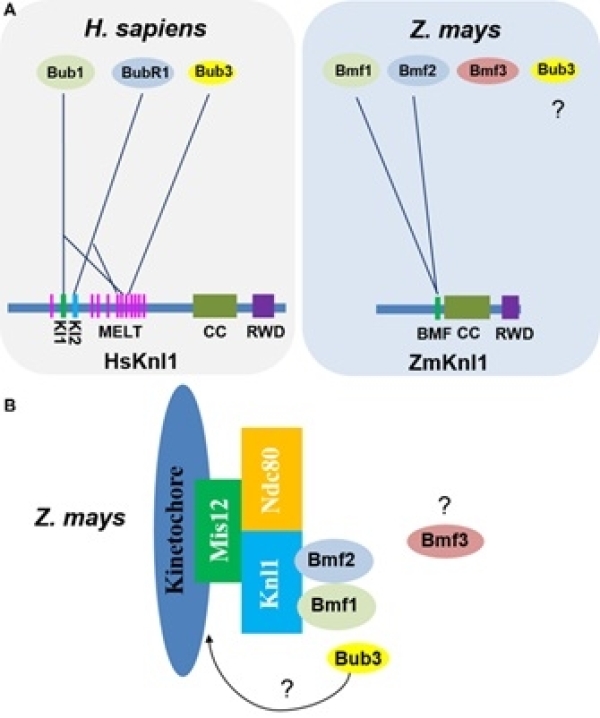
不同物种动粒Knl1和BMF蛋白家族间的结构比较







