可瑞生物首个免疫细胞治疗产品IND获批
昨日(11月21日),可瑞生物首个免疫细胞治疗产品CRTE7A2-01 TCR-T细胞注射液获得临床试验批准通知书,这标志着可瑞生物正式迈向注册临床试验的开展阶段。
CRTE7A2-01 TCR-T细胞注射液是由北京可瑞生物科技有限公司开发的免疫细胞治疗产品,该产品的适应症是HPV16阳性HLA-A*02:01阳性晚期实体肿瘤(宫颈癌、头颈部肿瘤、肛门癌和其他肿瘤类型)。2023年11月21日,可瑞生物在Pre-IND沟通交流会议和IND审评期间圆满解决CDE关切的所有问题后,获得了CRTE7A2-01 TCR-T细胞注射液的临床试验批准通知书,同时CDE官网公布了可瑞生物CRTE7A2-01 TCR-T细胞注射液的临床试验默示许可。这标志着可瑞生物正式迈向注册临床试验的开展阶段。

上图:药物临床试验批准通知书

上图:CRTE7A2-01 TCR-T细胞注射液临床试验默示许可
宫颈癌具有较高发病率且治疗需求未被满足
持续的高危型人乳头瘤病毒(HPV)感染已经被WHO确定为I类致癌因素,我国常见的高危型HPV包括16、18、31、33、45、52、58等,但HPV-16是HPV相关肿瘤中最常见的高危HPV类型。HPV感染与几乎所有的宫颈癌之间存在着因果关系,HPV感染还可以导致多种头颈癌和肛门生殖器肿瘤。其中,据2022年国家癌症中心报告数据显示,我国宫颈癌新发病例约有11.9万例,是女性恶性肿瘤第六位高发肿瘤。因宫颈癌死亡病例约有3.7万例,占全球宫颈癌疾病负担的20.2%,且发病率以每年10.5%的速度快速上升。目前宫颈癌的治疗方式主要包括手术、放疗及化疗,虽然早期宫颈癌规范治疗后多数患者能够实现长期存活,但仍有部分患者出现复发。国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)分期为IB-IIA期宫颈癌患者的复发率为11%~22%,FIGO分期为IIB-IV期患者的复发率为28%~64%,转移性的晚期宫颈癌的5年存活率仅为10%左右。
TCR-T产品具有可行的治疗原理和广阔的靶点空间
TCR-T是通过相应的实验技术,克隆能够特异性识别特定HLA-肿瘤抗原肽复合物的T细胞受体(TCR)后,再通过慢病毒等基因递送的方式,将TCR基因编码序列递送至更多的T细胞中,赋予这些T细胞新的抗原识别特异性。患者来源T细胞经体外转导TCR基因、大量扩增,能够有效地识别肿瘤细胞特异性抗原,这些T细胞回输给患者,可特异性杀伤肿瘤细胞,发挥抗肿瘤活性。由于不论是胞内还是胞外抗原,均可以经由HLA呈递后被TCR识别,因此TCR-T可以靶向大部分的肿瘤特异性抗原,尤其是能识别那些肿瘤细胞内抗原(约占全部抗原的90%),因此TCR-T有望用于几乎所有肿瘤的治疗,尤其是各种实体肿瘤。
TCR-T产品可用于治疗HPV感染引发的宫颈癌等肿瘤
高危型HPV持续性感染是发生宫颈癌等肿瘤的重要病因,其机理为HPV E2功能的缺失,病毒基因组整合到宿主染色体,导致癌蛋白E6和E7持续性高表达,分别与细胞内抑癌基因p53和pRB相互作用,促进RAS GTpase活性和TRAF2表达增加,使细胞耐受因TNF-α刺激产生的凋亡,进而导致细胞增殖,导致染色体不稳定而引起细胞永生化。前期的研究发现,HPV16病毒的E7抗原可以被HLA分子有效呈递,成为被特异性TCR识别的理想抗原靶点。可瑞生物利用自建的领先研发平台,获得了对E7抗原活性极优且脱靶风险极低的TCR序列,然后利用该TCR开发出了TCR-T细胞注射液,用于清除HPV16阳性的肿瘤细胞。在临床前的研究中,该产品表现出了优异的活性和良好的安全性,并且已在前期的IIT研究中验证了该产品的安全性和有效性。这些工作为我们的注册临床试验打下坚实基础,我司会按照CDE批准的方案开展CRTE7A2-01 TCR-T细胞注射液治疗HPV16阳性HLA-A*02:01阳性晚期实体肿瘤(宫颈癌、头颈部肿瘤、肛门癌和其他肿瘤类型)的安全性、耐受性和初步疗效的I期临床研究。
-
产品技术

-
产品技术

-
会议会展

-
企业风采

-
科技前沿

-
焦点事件

-
企业风采

-
企业风采

-
财报

-
科技前沿

-
企业风采

-
科技前沿
-
焦点事件

-
企业风采

-
科技前沿
-
标准

-
企业风采

-
焦点事件

-
人物动向

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
企业风采

-
企业风采

-
产品技术

-
企业风采

-
项目成果

-
投融资
-
焦点事件

-
项目成果
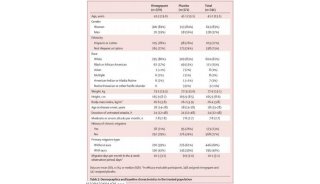
-
科技前沿
-
并购

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
项目成果

-
产品技术
-
企业风采

-
产品技术
-
实验室动态

-
焦点事件