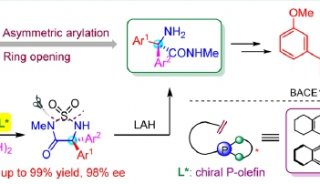
手性季碳氨基酸不对称合成获进展
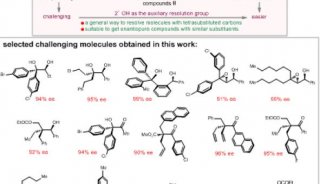
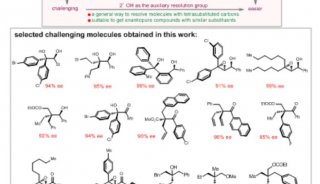
2月18日,从中科院上海药物研究所徐明华课题组传来消息,该课题组自主设计的新型开链结构的简单磷—烯为手性配体,用于铑催化的硼酸对4-芳基-3-羰基-1,2,5-噻二唑类底物及其衍生物的不对称芳基化反应中,成功实现了含季碳手性的二芳基取代的系列1,2,5-噻二唑啉酮类化合物的高对映选择性合成,产物经简单开环便可以得到结构重要的各种芳基取代的光学活性氨基酰胺及异吲哚啉、异吲哚啉酮。
手性非天然氨基酸结构广泛存在于天然产物、药物分子和多功能材料中,作为重要合成砌块在有机合成中也有广泛的应用。由于其结构的特殊性,一些高效合成手性非天然氨基酸的方法,如不对称氢化,无法用于构建手性季碳氨基酸类化合物。手性α,α-二芳基取代的氨基酸类化合物由于存在两个立体芳基区分起来十分困难,因此它们的高对映选择性合成是一个极富挑战性的课题。
目前现有的构建手性α,α-二芳基氨基酸的方法,主要是通过有机催化的不对称Strecker反应来实现,但具有较大的底物局限性,通常需要在一个芳基的邻位有取代基以控制反应的立体选择性,而且氰基需要在酸性条件下加热水解转化为羧基。而由该课题组设计的方法操作简单、条件温和、立体选择性高、底物适用范围广,为今后手性α,α-二芳基氨基酸化合物用于相关药物研究提供了可能。目前,该方法已成功用于默克公司报道的BACE-1抑制剂(R)-iminohydantoin (Ki79nm)的首次催化不对称合成。
推荐
-
科技前沿
-
项目成果
-
焦点事件
-
焦点事件
-
焦点事件