PCR(聚合酶链式反应)反应方法注意事项
1. PCR引物设计:
引物设计可能是PCR扩增成功最关键的因素。如引物设计欠佳,可能导致扩增产物不足,甚至扩增失败,其原因是设计欠佳的引物可导致非特异扩增和/或形成引物二聚体,此又成为PCR反应的竞争性产物,从而进一步抑制PCR产物形成。
在引物设计时必须考虑以下几个因素,其中最重要的是引物长度、溶解温度(Tm)、特异性、引物序列互补问题、G/C 含量和多嘧啶(T,C) 或多嘌呤(A, G)延伸、3’-末端序列等。
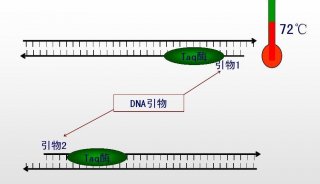
(1)引物长度:由于PCR反应的特异性、退火温度以及时间均至少部分与PCR引物长度相关联,因此引物长度是PCR扩增是否成功关键的因素。一般PCR引物长度为15-30核苷酸。
(2)溶解温度(Tm):因加热而断开H键,使双链DNA分开或“溶解”为单链DNA。溶解温度(Tm)即指使一半双链DNA变为单链DNA的温度。Tm可采用下列公式计算:Tm=2(A+T) + 4(G+C)。
需注意PCR反应至少有两个(一对)引物,两个寡核苷酸引物Tm 值应比较接近,不可差异过大。因有较高的Tm值的引物在较低的反应温度时可发生错配,而引物Tm值较低,反应温度较高时则可能不能发生作用,因此如引物的Tm值差异较大,可导致PCR扩增效率低下甚至扩增失败。
(3)引物序列互补:设计引物时应绝对没有3个碱基以上的内引物配对,如引物有这样具有自我配对的区域,“弹回”即部分双链结构将发生在退火反应时。
(4)G/C 含量和多嘧啶(T,C) 或多嘌呤(A, G)延伸:待选择的引物序列应尽可能是碱基随意分布,G+C含量平均-避免长A+T和富含G+C的区域。在引物的碱基组成中GC含量一般为45%-55%。在选择的引物序列中应没有多G 或多C延伸,因其可促进非特异性退火,多A 和多T延伸也应避免,因其可“呼吸”和使引物-模板复合物展开延伸,降低扩增的效率。同时多嘧啶(T,C)和多嘌呤(A,G)延伸也应被避免。
(5)3’-末端序列:为控制引物错配,应认真地确定PCR引物中3’末端的位置。
总而言之,应重视PCR引物设计,设计PCR引物时应认真小心。对于一个成功的PCR来说,几个重要因素如引物长度、GC含量和3’序列必须优化。理想的引物应为差不多随意分布的核苷酸混合、GC含量50%、长度约为20个碱基,因此能使Tm值处于56-62ºC范围。分析靶基因潜在引物位点时,应考虑无单聚合体, 没有明显的二级结构形成的倾向,不自我互补,与其他双链靶基因序列没有明显的同源性。为避免枯燥无味的设计,节省时间,减少错误,可应用计算机程序优化设计、选择、确定寡核苷酸引物。
最常用的引物设计软件和网站是:http://www-genome.wi.mit.edu/cgi-bin/primer/ primer3_www.cgi
2. 模板DNA:
溶解模板DNA于含有低浓度的EDTA(<0.1 mM)的10mM Tris-Cl(pH 7.6)中。DNA的浓度分别为:哺乳动物基因组(100 µg/ml),酵母基因组DNA(1 µg/ml),细菌基因组DNA(0.1 µg/ml),质粒DNA(1-5 µg/ml)。
3. 防止污染:由于PCR能够使单个DNA分子得以扩增,所以应当注意防止反应体系被痕量DNA模板污染,尤其是在待扩增靶序列浓度低的情况下,更有必要采取防备措施。
(1)如有可能,应在装有紫外灯的层流式工作台内吸加PCR试剂和进行反应。凡不用工作台时应打开紫外灯。应使工作台内始终置有PCR专用的微量离心机、一次性手套、整套移液器和其他必需品。由于自动移液器的管部是常见的污染源,因此配液和移液时应当使用配有一次性吸头和活塞的正向排液式移液器。准备一套特殊的试剂和溶液专用于PCR。所有的玻璃器皿于150ºC下烘烤6小时,所有塑料器皿、缓冲液、吸头和离心管使用前必须经过高压处理。
(2)一旦进入吸加PCR试剂的专用场所并开始工作,就应戴上一副新手套,并应勤于更换。
(3)准备专供自己使用的成套试剂,分装为小份,而且最好在靠近工作台的冰箱中设立专门位置来保存。这些试剂不得用于其他用途。配制这些试剂时,要用从未接触过实验室内所用任何DNA的新玻璃用具、塑料用具和移液器。使用后便将这一小份全部废弃,不得重新置存。
(4)装有PCR试剂的微量离心管打开之前,应先在专用工作台内的微量离心机上作瞬时离心(10秒)。这样可使液体沉积于管底,从而减少污染手套或加样器的机会。
(5)最好在加完所有的其他反应成份、包括防止蒸发用的矿物油后才吸加模板DNA。将模板加入微量离心管后,盖好离心管并用戴有手套的手指轻轻弹击管侧壁,以混匀液体。再作瞬时离心(10秒),使水相和有机相分开。
(6)将模板DNA加入PCR系统时,注意切勿形成喷雾,后者有可能污染别的反应。所有并非即用管均应盖严。拿过模板DNA管后应更换手套。
(7)每一次PCR必须包含阳性和阴性对照。阳性对照用于监测PCR反应的效率,而阴性对照用于确定是否存在DNA靶序列的污染。
(8)只要有可能,就应当设置阳性对照反应(即由少量适当的靶序列参与的PCR)。对靶序列DNA所作的适当稀释工作应于实验前在实验室内别的位置进行,这样可防止将靶DNA的浓溶液带到实验室专门进行PCR的位置。
(9)必须设置一个不含模板DNA,但含有PCR系统中所有的其他成份的对照反应,这一对照管须在准备好其他所有PCR以后才进行吸加。
4.我们上面介绍的只是一种基本的PCR反应条件,对于具体的每一种PCR反应,反应条件差异很大,需要根据情况调整。
(1)时间:上面介绍的时间适用于在0.2 ml薄壁管进行PCR反应,其反应体积为50 µl,热循环仪为Perkin-Elmer 9600 或9700、Master Cycler PCR仪(Eppendorf公司)和PTC 100(MJ Research公司)。如PCR的设备和反应体积发生改变,则时间和温度均需要调整。
每一步的时间应从反应混合物达到所需要的温度后开始计算。一般来说,由混合液原温度达到所要求温度的时间需要30-60秒。温度滞后时间的长短取决于以下几个因素,包括反应管的类型、反应混合物的体积、热源(水浴或加热块)以及两个连续步骤间的温度差。因此调节温育时间以补偿这一滞后时间是非常重要的。
两寡核苷酸引物之间的距离越远,合成靶序列全长所需的时间也越长。上面给出的反应时间是按1000个核苷酸的靶序列拟定的。
(2)温度:选择寡核苷酸引物到DNA模板的退火温度是一个折衷的方案。如果降低退火温度则扩增效率提高,但引物与模板间的错配现象又可明显增加。若将温度提高,则扩增反应的特异性增加,但总的反应效率则会下降。因此理想的办法是设置一系列对照反应,以确定某一特定扩增反应的最适退火温度。
(3)循环次数:扩增反应的循环数取决于反应混合液中靶DNA的浓度,若将哺乳动物基因组中单拷贝基因扩增至能为琼脂糖或聚丙烯酰胺凝胶电泳所见,至少需要25个循环。
靶序列的指数式的扩增不是一个无限制的过程。在正常反应条件下,经过25-30个循环扩增(即扩增约106倍)后,Taq DNA聚合酶的酶量便成为制约反应进行的因素。如需进一步扩增,应将所得的DNA样品稀释1000至10000倍后,再作为模板进行新的PCR。
(4)缓冲液:当标准缓冲液于72ºC温育时,反应体系的pH值将下降1个多单位,致使缓冲液的pH值接近7.2。二价阳离子的存在至关紧要,镁离子优于锰离子,而钙离子则无效。镁离子的最佳作用浓度相当低(1.5 mM),因此重要的是,所制备的模板DNA中不应含有高浓度的螯合剂,如EDTA;也不应含有高浓度的带负电荷离子基团,如磷酸根。所以,用作模板的DNA应溶于10 mM Tris-Cl (pH 7.6), 0.1 mM EDTA (pH 8.0)中。
在较为广泛的范围内,这种标准缓冲液对于各种模板的寡核苷酸引物都能行之有效,当它并非对于模板与引物的任何一种特定组合都是最佳的。因此,应当将以上所列条件作为出发点进行修饰和改良。每当首次使用靶序列和引物的一种新组合时,或者,dNTPs或引物的浓度变化时,特别要将Mg2+浓度调至最佳。dNTPs是反应中磷酸根的主要来源,其浓度的任何变化都将影响到Mg2+的有效浓度。我们建议设置一组反应,其中每一反应的Tris-Cl (10 mM)和氯化钾 (50 mM)浓度相同,而氯化镁浓度不同(0.05-5 mM,每次增加0.5 mM)。反应结束后,通过琼脂糖凝胶电泳和溴化乙锭染色来比较各扩增产物的量。
PCR可在热循环仪(即PCR仪)中自动进行,以使反应各循环标准化。
5. 一般来说,如第一次用新的模板DNA、新的引物或者新制备的耐热DNA聚合酶作PCR,扩增将不如预期理想。PCR反应条件需仔细调整,以抑制非特异扩增和(或)提高目标DNA的产量。
6. 一个成功的PCR扩增反应,可出现一个显而易见的与预期大小一样长度的DNA片段,此可通过DNA序列分析、Southern 杂交和或限制性图谱分析确定。
-
技术原理