Nature长文:GPCR药物大盘点
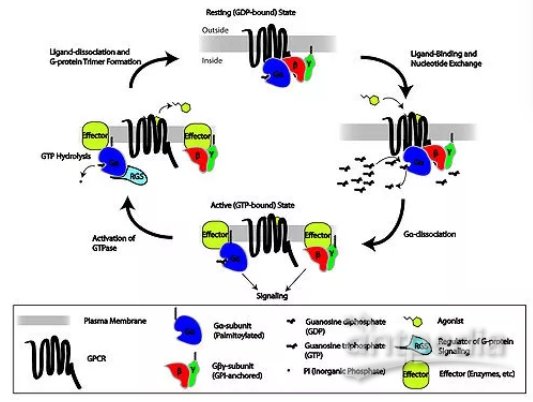
G蛋白偶联受体(G protein-coupled receptors,GPCRs)家族是人类中最庞大的膜蛋白家族,也是很多药物的重要靶点。这个家族中有800多个成员,其中包括400个左右嗅觉受体。据统计,靶向GPCR的药物销量占全球市场的27%。GPCRs一直是药物研发的重要靶点之一,因为它们能够调控多种广泛的生理过程,而且在细胞表面具有可以成药的靶点。而且,最近对GPCRs的研究开辟了开发GPCR药物的新策略。例如,靶向GPCR的别构结合位点(allosteric sites)可以改变受体的结构、动态平衡和功能,从而提高治疗效果。而且,对受体激活机制的深入研究让研究人员可以设计出偏向激活特定细胞内信号通路的激动剂,从而减少因激活其它信号通路产生的副作用。如今44个独特的GPCRs和205个配体-受体复合体的晶体结构已经得到解析。这些发现为基于结构的药物研发和设计提供了坚实的基础。近日,丹麦哥本哈根大学(University of Copenhagen)的科学家们对所有GPCR药物和在临床试验中接受检验的在研GPCR药物进行了盘点,他们的分析发现了GPCR药物研发方面的哪些趋势呢?下面我们来看一看:
▲G蛋白偶联受体(图片来源:维基百科)
GPCR药物和临床期在研药物分类
获得FDA批准的靶向GPCR的药物总计475种,占所有FDA批准药物的34%。近5年来,美国FDA批准了69种靶向GPCR的新药,这一数据现实出GPCR药物研发的快速进展。而临床期在研药物中有321种靶向GPCRs,其中60种(19%)药物靶向的是创新GPCR靶点。
对所有药物和在研药物按照靶点性质分类可以看出以下几个特征:
1. 已有靶点日趋饱和
475种已经获得批准的GPCR药物靶向总计108个GPCR靶点,这只占人类非嗅觉GPCRs的27%。目前已经被确认的GPCR药物靶点中,每个靶点平均被10.3个不同的药物靶向。这意味着已有靶点空间已经接近饱和,开发新药需要发现新的能够成药的受体。对于那些具有很大未满足医疗需求而且靶点缺乏的疾病来说(例如,阿兹海默病),发现新靶点尤其值得一试。
2. 多肽或蛋白激活的GPCRs受到关注
临床期在研药物的靶点中有66个创新GPCR靶点。在这66个创新靶点中,有37种是多肽或蛋白激活的GPCRs,其中包括治疗2型糖尿病的胰高血糖素(glucagon)受体家族和治疗偏头痛的CGRP受体。而且,有22种在研药物靶向趋向因子受体,它们治疗包括癌症、哮喘、类风湿性关节炎和艾滋病等多种疾病。这些新的靶点广泛地分布在不同类别和家族的GPCRs中,显示出新的研发策略对发现创新靶点的帮助。
3. 孤儿受体进入临床试验
值得注意的是有几项临床试验的靶点是孤儿GPCRs,这些受体的内源性配体还未被发现。这些孤儿GPCRs靶点可能被用于治疗糖尿病、胃肠道疾病和过敏炎症等一系列疾病。这证明了即便对受体的内源性配体或信号通路了解有限,药物研发过程仍然可以进行并且进入临床试验阶段。能够进入临床试验是一个重要的分水岭,因为它标志着临床前研究结果和与疾病的相关性达到了需要在人体中进一步检验的要求。
在研药物的类型和作用机制
1. 早期临床试验中靶向GPCR的生物制剂比例增加
包括单克隆抗体在内的生物制剂已经成为一种成熟的医疗方法,在2014~2016年间占FDA批准新药的27~33%。但是,目前还没有一例靶向GPCR的单克隆抗体获得FDA批准。不过这一空缺可能很快就将被填补。目前有16种靶向GPCs的单克隆抗体在临床试验中治疗包括癌症、炎性疾病、和代谢类疾病等多种病症。其中,诺华(Novartis)靶向CGRP受体的单克隆抗体erenumab在治疗偏头痛的临床试验中表现出色。近日诺华宣布erenumab在治疗偏头痛患者的临床3b期试验中达到了所有主要和次要终点。这些患者接受过多次其它疗法的治疗而且症状没有得到改善。诺华已经向FDA递交了erenumab的新药申请。
而靶向胰高血糖素样肽-1(glucagon-like peptide 1,GLP1)受体的多肽药物已经获得批准治疗2型糖尿病,其中包括exenatide,liraglutide,lixisenatide,albiglutide 和dulaglutide。而且还有更多靶向GPCR的多肽药物处于临床开发阶段。例如,bremelanotide是一种黑皮质素(melanocortin)受体的激动剂,它在治疗女性性功能失常的两项临床3期结果中取得积极结果。预计该药物的新药申请将在2018年递交给FDA。
总体来说,有征兆表明小分子以外的药物形式开始成为更流行的靶向GPCR的方式。表现在多肽药物、单克隆抗体和重组蛋白在临床1期试验中占有的比重高于2、3期临床试验。
2. 更多别构调节剂出现在早期临床试验中
别构调节剂(allosteric modulators)是一种很具吸引力的创新调控机制,它们可以远程调控生理配体与受体结合引发的受体活性。这一机制通常具备以下几种优势:对靶点更高的特异性(可能由于别构位点在受体家族中保守型较弱),更好的时间特异性(与别构位点的结合导致内源性配体的释放),和功能上的特异性。已有的别构调节剂包括cinacalcet。它是一种钙离子感知受体(Calcium sensing receptor,CaS)的正向别构调节剂,可以用于治疗甲状旁腺功能亢进。别构数据库中目前列举了27769种靶向GPCR的别构调节剂。其中有数种正向或反向别构调节剂处于临床1期和2期试验阶段。
3. 对靶点特异性的重视
很多药物通过与多个靶点相互作用来媒介它们的疗效,这种作用方式称为 “polypharmacology”。对靶向GPCR的在研药物的分析表明,在早期临床试验中被检验的药物对靶点的特异性明显增强。在临床1期中接受检验的药物的靶点少于已经被停用的药物的靶点数目。这似乎显示出研发机构对药物特异性的重视。
靶向GPCR药物适应症的发展趋势
研究表明,靶向GPCR药物的适应症正在从诸如高血压、过敏、麻醉和精神分裂症等传统领域中扩展到像AD和肥胖症等新领域。而且在过去5年里,GPCRs成为治疗多发性硬化症(multiple sclerosis,MS)、 戒烟、和短肠综合症等新适应症的靶点。下面是GPCR药物适应症的一些发展趋势:
1. 中枢神经系统疾病仍然是靶向GPCR药物适应症的重要组成部分
在已经被批准的靶向GPCR的药物中,治疗中枢神经系统疾病的药物占26%,而且至少有79种靶向GPCR的临床期在研药物是用于治疗中枢神经系统疾病的。由于超过50%的非嗅觉GPCRs在大脑皮层中表达,而且GPCR媒介的神经递质传导失常可以导致多种神经和心理疾病。因此,神经系统疾病将持续成为靶向GPCR药物的重要适应症之一。其中,MS、AD、亨廷顿病和脆性X染色体综合征是尤为值得关注的领域。
在MS领域,已经有一种靶向GPCR的药物获得批准。它是调节S1P1受体功能的fingolimod。另外有多种S1P1调节剂处于临床2期和3期试验中。此外,针对大麻素受体(cannabinoid receptor)和 GPR55等其它GPCR靶点的药物也在临床2、3试验中接受检验治疗MS。这些进展预示着通过与 GPCR相互作用治疗MS 的更多疗法可能不久即将问世。
2. 糖尿病是靶向GPCR的临床期在研药物的重要适应症
治疗代谢类疾病药物的市场份额的增加也反映到了靶向GPCR的临床期在研药物当中,其中有27种在研药物用于治疗糖尿病,7种治疗肥胖症。如前所述,针对GLP1受体的多肽药物已经上市,不过目前已经获得批准的药物都是注射型药物,口服型靶向GLP1受体的多肽药物和小分子药物正处于临床2期和3期试验中。
在治疗糖尿病和其并发症方面,目前有25个GPCR新靶点在临床试验中接受检验。其中值得关注的新靶点包括GPR119、FFA1受体和多巴胺D2受体。
3. 靶向GPCR药物在肿瘤学领域中的机会
目前有21种靶向14种不同GPCR的抗癌药物已经获得批准,其中包括GnRH受体拮抗剂和SMO受体抑制剂。在临床试验中,有23种靶向GPCR的在研药物用于治疗癌症,其中7种靶向的是创新靶点。这些创新靶点包括趋化因子受体和WNT信号通路中的蛋白。例如,CCR2是单克隆抗体plozalizumab的靶点,plozalizumab现在处于治疗黑色素瘤的临床1期试验中。靶向WNT信号通路中的FZD7蛋白的单克隆抗体在临床试验中用于治疗乳腺癌和胰腺癌。
新兴趋势和机遇
1. 新兴GPCR靶点
通过对ZL申请数据的整理,我们可以推测出哪些GPCR靶点是正在被制药公司积极研究的新兴靶点。根据从2014年到2016年十月ZL申请的数据,趋向因子受体是最被积极研究的靶点家族,有100多项ZL申请与之相关。随后是CaS受体,糖蛋白激素受体和Frizzled受体。另外有35项ZL申请是关于孤儿受体,包括GPR84,GPR1,GPR17 和 LGR5。
2. GPCR结构对药物研发的影响
基于结构的药物设计一直在药物研发过程中起着重要作用,特别是靶向酶类靶点的药物。然而,直到最近,对GPCR晶体结构解析方面的挑战一直限制了针对这些靶点结构的药物设计。不过最近在GPCR晶体学方面的突破让44种不同的GPCR和205种配体-受体复合物的结构得到解析。那么GPCR晶体学方面的进展对药物研发的影响如何呢?
数据表明,大多数被多种获批药物靶向的受体的晶体结构在2007~2012年间纷纷被解析。这一数据表明这些受体由于它们与疾病的密切关系首先被选为晶体结构研究的对象。然而,在临床1期和2期试验中被检测的很多在研药物也靶向这些靶点。这意味着它们的结构信息可能被用于加快先导化合物的发现或者优化过程。
3. 偏向激活特定信号通路成为达成功能特异性的新机制
GPCRs可以激活多条信号通路,激活合适的信号通路对获得有益的细胞反应和生理反应非常重要。最新研究表明有些分子能够有倾向性地激活特定信号通路,这提供了一条减少副作用的新机制。数个对特定G蛋白,别构调节或者β-arrestin有倾向性的药物正在临床前与临床试验中接受检验。其中最值得关注的是μ阿片受体(μ-opioid receptor)的配体oliceridine。它目前处于临床3期试验中,已经被FDA授予突破性疗法认定。Oliceridine 不会激活 β-arrestin信号通路,而这一信号通路与阿片导致的呼吸抑制和便秘相关,因此oliceridine作为麻醉剂的副作用更小。
对有倾向性地激活特定信号通路的药物在医疗方面应用的研究才刚刚开始。我们还需要对GPCR媒介的信号通路进行更全面地了解。另外,在动物模型中发现新方法来确认倾向性激活信号通路将为这些药物的临床前与临床开发提供重要的工具。
靶向GPCRs的未来
GPCR家族已经被证明的成药性和它们在糖尿病、肥胖症、AD以及心理疾病方面的重要作用仍将成为促进GPCR药物研发领域的主要推动力。从目前出现的大量新靶点和对GPCR结构生物学,药理学和模型的研究兴趣来看,GPCR药物研发领域的进展还将进一步加速。
GPCR药物研发的未来将基于解决几个关键问题:
1. 我们需要合适的工具性化合物来确定靶点的生物功能和与疾病的相关性。创新的高通量配体鉴定方法(例如DNA编码化合物库)可能帮助发现这些化合物。
2. 我们需要改进的疾病模型和基因工程系统来进行药物靶标确认(target validation)。CRISPR之类的基因编辑技术可以提供这方面的帮助。
3. 庞大驳杂的化合和生物数据需要被整理成为长期共享的数据库,比如ChEMBL,Guide to Pharmacology和GPCRdb。这些工作不是任何一个单位可以完成的,它们需要基础和应用GPCR领域的跨学科合作和公私伙伴关系来加快这些方面的进展。