FLIPRTETRA系统检测Gi-和Gs偶联GPCR介导的第二信使cA...(一)
FLIPRTETRA系统检测Gi-和Gs偶联GPCR介导的第二信使cAMP信号变化
简介
在这篇应用文献中我们展示了基于Promega公司 GloSensor. cAMP 实验中的修改后的发光萤火虫荧光素酶的应用。在FLIPR.Tetra高通量筛选系统进行cAMP水平的检测以保证在动力学模式下精确检测Gi和Gs偶联的GPCR活性。通过这样的实验,基于对细胞内相关第二信使cAMP浓度变化的检测可以对GPCR亚型进行评价。Gi和Gs偶联GPCR的第二信使信号活性的检测传统方法一般采用放射性结合或需要细胞裂解的终点法cAMP实验方法。这些类型的实验都是检测一个单独时间点下的细胞反应和活性,不能提供动力学信息。另一种选择时采用强制耦合到GÞ16的Gs-和Gi- GPCRs,检测受体激活后钙离子流引发的荧光信号检测。然而,这种方法由于不是直接的反应cAMP通路生物相关性信号变化,只能作为第二位选择。我们展示了稳定表达Glosensor质粒的CHO-K1和HEK-293细胞系中的内源性受体活性。另外,在瞬时转染了Glosensor质粒的细胞系中检测了稳定转染的Gs-和Gi-偶联受体活性。结合Glosensor cAMP方法,FLIPRTetra系统建立了一个灵活的完整解决方案用于GPCR主要亚型的动力学筛选。
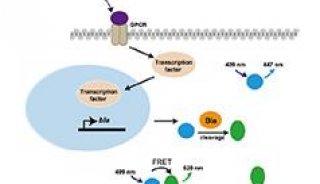
如图1所示,Glosensor cAMP检测实验主要通过cAMP结合域融合到野生型的萤火虫荧光素酶的N-和C-末端来实现。cAMP缺乏时,基因修饰过的含有cAMP结合域的荧光素酶处于未激活状态。一旦结合了cAMP后,cAMP结合域构象发生变化处于激活状态引起化学发光信号增加,从而被FLIPRTetra系统检测到。更多关于Glosensor cAMP实验的信息可参考技术手册(Cat# TM076, Promega)。
结合质粒瞬时转染或稳定转染的灵活的Gs-和Gi-偶联的GPCR实验设计是可行的。四种可供选择的来自Promega的细胞系或靶标细胞系见下:
灵活的GloSensor cAMP 实验设计
Stable receptor and stable GloSensor cAMP assay
Transient receptor and stable GloSensor cAMP assay
Stable receptor and transient GloSensor cAMP assay
Transient receptor and transient GloSensor cAMP assay

FLIPR Tetra 系统:
• 超灵敏ICCD相机既可以对化学发光检测,同时也可以检测荧光信号
• 活细胞中动态的cAMP冷光信号检测通过FLIPRTetra系统的超灵敏ICCD相机来实现
• 实验通量: 96-, 384-和1536-孔记录板规格,可很方便与自动化设备整合
材料
cAMP细胞系和质粒
• GloSensor cAMP HEK 293 stable cell line (Promega Corporation, Cat. #E1261)
• GloSensor cAMP 23F CHO K1-stable cell line (Promega R&D)
• Rat Y2R/GloSensor cAMP 23F CHO-K1 double stable cell line (Promega R&D)
• GloSensor cAMP assay plasmid pGlosensor-22FcAMP (Promega, Cat. #E2301)
• Dopamine D4 stable HEK 293T cell line (Multispan Inc., Cat. #C1338)
细胞培养试剂
. HEK 293 cell growth medium: 90% DMEM (Life Technologies, Cat. #11995- 065), 10% FBS (Hyclone, Cat. #SH.30071), 200 μg/mL hygromycin B (Sigma, Cat. #H3274)
. GloSensor cAMP-23F CHO-K1 cell growth medium: 90% F-12 Medium (Life Technologies, Cat. #11765), 10% FBS, and 200 mg/mL hygromycin B)
. Glo Sensor cAMP-23F/Y2R CHO-K1 double stable cell growth medium: 90% F-12 Medium (Life Technologies, Cat. #11765), 10% FBS, and 200 μg/mL hy- gromycin B), and 500 μg/mL G418 (Life Technologies, Cat. #10131027)
实验试剂
• Plating medium: 90% CO2-independent medium (Life Technologies, Cat. #18045), 10% FBS
• HEPES buffer: Re-suspend HEPES in deionized water to 10 mM; adjust pH to7.5 using KOH
• GloSensor cAMP Reagent stock solution: Re-suspend 250 mg GloSensor cAMP Reagent (Promega, Cat. #E1291) in 8.17 mL of HEPES buffer; store at -70°C in single-use aliquots
• 平衡溶液:种植液(见上)和2%或5% GloSensor cAMP 试剂;需根据具体实验情况进行优化 • 化合物:(-)异丙肾上腺素(Sigma, Cat. #I6504); 羟甲叔丁肾上腺素(Sigma, Cat. #S8260); 普萘洛尔(Sigma, Cat. #P0884); 吲哚洛尔(Sigma, Cat. #P0778); 阿普洛尔(Sigma, Cat. #A8676); 多巴胺 (Sigma, Cat. # H8502). Peptide YY(3-36), (Tocris Cat. #1618); 所有化合物母液均配置为10 mM ,添加HBSS + 20 mM HEPES做进一步的稀释
方法
稳定的GloSensor cAMP 细胞系实验方法
Step 1. 细胞在384孔黑壁底透的细胞板(Corning, Cat. #3712)中过夜培养。
Step 2. 实验前2小时,去除培养基并在37°C和5% CO2条件下培养细胞1小时,然后每孔加入含Glosensor cAMP试剂的平衡溶液30 μL室温下在放置1小时。
• HEK细胞孵育在含2% Glosensor cAMP试剂的平衡溶液中
• CHO-K1 细胞孵育在5% Glosensor cAMP试剂中
Step 3. 动力学检测过程中通过FLIPRTetra系统添加5X化合物
Step 4. 每10秒或30秒曝光一次,持续10-25分钟
Step 5. 一般来说,由于较低的动力学变化Gi-偶联的受体实验需要更长的时间。FLIPR参数设置见表1.
Step 6. 数据结果从FLIPR的ScreenWorks®软件输出到Graphpad Prism 5 进行分析
GloSensor cAMP 瞬时转染方法用于稳定表达GPCR受体的细胞和内源性受体的细胞
Step 1. 在培养瓶中不加抗生素条件下37°C和5% CO2过夜培养细胞,密度可达到70-80%。
Step 2. 在Opti-Mem-无血清培养基中稀释pGloSensor cAMP质粒至20 ng/mL,使得step 4中每毫升细胞体系中含1-μg DNA/mL (Life Technologies, Cat. #31985)。
Step 3. 添加Fugene HD 转染试剂混合物(Roche, Cat. #0409705001),比例是3:1每微克DNA并轻柔混合后室温下孵育15分钟。试剂(μL) 与DNA (μG)的比例是3:1。
Step 4. 添加DNA复合物至含0.48 million per mL细胞的离心管中(种植时12000 cells/25 μL/well for HEK-D4; 取决于细胞).
Step 5. 根据不同的细胞系,在每孔25微升体系中种植8000–12000个细胞,并在37°C和5% CO2条件下培养2天。
Step 6. 实验当天,轻柔的去除培养基并添加30μL 2–6% f/v GloSensor cAMP试剂至平衡液中。
Step 7. 37°C孵育1小时并在室温下放置1小时。
Step 8. 参照表1中FLIPR系统的参数设置,在动力学检测过程中添加6X 化合物。