《自然·纳米技术》:血管正常化治疗手段或将提高抗癌效果
靶向抑制肿瘤血管是通过阻断肿瘤血管生成途径,切断肿瘤细胞营养供应,达到抑制肿瘤生长的治疗手段。然而,它只能在一定程度上减少肿瘤血管,而且其副作用也不能忽视,包括诱导肿瘤缺氧、募集促血管生成和促炎症的基质细胞以及减少化疗药物的渗透等。所以只是简单地抑制血管生成并不能达到遏制肿瘤生长的作用。
2005年著名肿瘤病理学专家Jain, R. K.在《Science》提出一种全新的治疗肿瘤的概念:肿瘤血管正常化,即通过肿瘤血管功能的正常化与细胞毒性疗法相结合的治疗手段,提高抗癌效果。这一概念从根本上改变了科学家和临床医生对抗血管生成药物如何起作用,以及如何将它们与其他疗法结合以改善患者的治疗结果的看法。

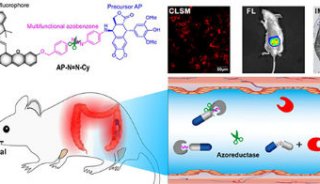
中国台湾国立清华大学YunChing Chen教授研究团队,近日报道了一种纳米释放系统(NanoNO),通过在肿瘤区域释放NO,建立NO梯度,促进肿瘤微环境血管正常化。他们以肝细胞癌(HCC)为研究模型,利用NanoNO纳米释放系统在肿瘤微环境中建立NO梯度,使得肿瘤环境中的血管正常化,增强小分子和大分子抗癌药物在HCC模型中的传递。达到抑制肿瘤的目的。该研究成果以题为“Delivery of nitric oxide with a nanocarrier promotes tumour vessel normalization and potentiates anti-cancer therapies”的论文发表在《自然·纳米技术》上(见文后原文链接)。
【纳米释放系统(NanoNO)抑癌设计】
研究者首先将NanoNO注射到小鼠血管中,NanoNO到达肿瘤部位,释放NO,增强周细胞覆盖,增加血管灌注,减少肿瘤缺氧,从而促进肿瘤血管正常化,进而增强小分子抗癌药物(DOX,阿霉素)、大分子治疗药物(如重组肿瘤坏死因子(TNF)相关的凋亡诱导配体(TRAIL))和癌症疫苗在HCC模型中的递送,抑制肿瘤(图1)。

图1:显示NanoNo抑制小鼠HCC的示意图。从NanoNO释放的NO建立血管周围NO梯度,促进肿瘤微环境的改变。(1)低剂量NanoNo使肿瘤血管正常化。(2)低剂量NanoNo增强了小分子抗癌药物和大分子治疗药物的传递,协同抑制肿瘤。(3)在HCC中,NanoNO下调免疫检查点蛋白PD-L1的表达,抑制TAMs向免疫抑制的m2样表型的极化,增加T细胞肿瘤浸润。(4)低剂量NanoNo联合免疫治疗,使用cGM-CSF修饰的癌症疫苗,协同抑制肿瘤。
【纳米释放系统NanoNO的设计】
研究人员将DNIC [Fe(μ-SEt)2(NO)4]封装在lipid-PLGA纳米颗粒组成NanoNO,其平均直径为119 ± 12 nm。DNIC的包封设计提高了其稳定性,将其半衰期延长至24.4 ± 2.5 h。而当NanoNO进入肿瘤环境中,在酸性核内体/溶酶体的作用下,半衰期为3.9 ± 1.5 h。同时,与游离的DNIC相比,NanoNO稳定释放NO超过了48小时。这都说明了NanoNO是一个理想的NO释放系统,可以在肿瘤环境中稳定地发挥作用。

图2:NanoNO在肿瘤中积累,释放并介导抗肿瘤作用a,典型的透射电镜图像。NanoNO的尺寸、多分散性指数、zeta电势和包封效率。b,不同pH条件下DNIC和NanoNO中的DNIC的降解情况。c,在生理条件下(pH 7.4),DNIC和NanoNO的NO的释放。d,319例HCC患者的NOS2和NOS3 的mRNA谱。 e,自由形态DNIC和NanoNO在HCC细胞和HUVECs中表现出细胞毒性。 f,不同状态下(包封和游离),DNIC在血清中的浓度。g,DNIC在不同状态下的组织分布。h,HCC肿瘤的染色照片显示给药4小时后,NanoNO和DNIC在小鼠体内的DNIC摄取(绿色)和NO释放(红色)。 i,NO在血管周围区域释放。在小鼠体内注射NanoNO或DNIC (10 mg kg 1)后4小时,肿瘤区域检测到NO释放(红色)。j,NanoNO治疗方案示意图。在肝癌细胞植入后10天,分别在第10、12、14、17、19和21天给予不同剂量的NanoNO,并在第24天测量肿瘤大小。
【肿瘤血管正常化,提高抗癌效率】
NO在肿瘤微环境中是调节血管生成和维持血管系统功能的重要调节因子。NanoNO在血管周围建立的NO梯度还可使扭曲的肿瘤血管结构和功能恢复正常。作者研究了小分子化疗药物(doxorubicin, DOX)和大分子蛋白治疗药物(tnf相关的凋亡诱导配体,TRAIL)联合NanoNO在肝细胞癌模型中的肿瘤穿透性和抗癌效果。结果显示低剂量NanoNO治疗使DOX对原位肝癌肿瘤的穿透增加2.5倍,而高剂量NanoNO治疗未见改善。大分子蛋白治疗药物与NanoNO联合使用后,与单纯使用TRAIL治疗相比,低剂量NanoNO联合TRAIL治疗可显著增加原位HCA-1肿瘤凋亡细胞的数量。

图4:低剂量NanoNO提高药物传递效率,增强抗癌效果。a,治疗方案。肝癌细胞移植后10天,小鼠静脉注射NanoNO与联合阿霉素或重组TRAIL蛋白治疗。移植后第24天对肿瘤进行分析。b,共聚焦显微镜观察在肿瘤中的DOX。c,治疗组和未治疗组(对照)小鼠中Day24 HCC肿瘤的数量。d,通过多光子成像监测低剂量NanoNO使用后,血管正常化治疗后FITC-BSA在肿瘤中的渗透。e,TRAIL联合低剂量NanoNO治疗显著增加了肿瘤细胞凋亡的诱导。f,低剂量NanoNO (0.1 mg kg 1)联合重组TRAIL蛋白(低剂量,5 mg kg 1)治疗后原位HCC肿瘤的体积。g,ccl4诱导的HCC模型的治疗方案。i,用流式细胞术检测低剂量NanoNO治疗后肝癌细胞中Hoechst 33342+细胞的百分比。j,TRAIL联合低剂量NanoNO增加了ccl4诱导的HCC肿瘤的凋亡。