LncRNA发生m5C异常修饰或成肝癌诊断新靶点的应用
前言:
近年来,异常RNA修饰与肿瘤发生的关系引起了广泛关注。作为一种广泛存在的修饰,DNA和RNA中的5-甲基胞嘧啶(m5C)已被发现数十年。DNA
m5C修饰在肿瘤发生中的作用已被广泛研究。然而,关于RNA
m5C修饰在肿瘤发生中的作用知之甚少。NSUN2是哺乳动物中主要的m5C修饰甲基转移酶之一,在RNA代谢过程中起重要作用。近期,云序客户在一项研究中通过云序提供的转录组测序结合m5C-Bis-Seq测序的方法,首次发现H19 LncRNA是NSUN2 RNA甲基修饰酶的特异靶点。该结果帮助我们更深的理解RNA生物学和人类疾病中m5C RNA甲基化的功能,同时可为肝癌的诊断和治疗提供潜在的靶点和生物标志物。

发表期刊:Oncogene
影响因子:8
研究方法:m5C-Bis-Seq测序,全转录组测序,RNA pull down+质谱分析,蛋白免疫沉淀
文章链接:Aberrant NSUN2-mediated m5C modification of H19 LncRNA is associated with poor differentiation of hepatocellular carcinoma
研究内容:
(1)NSUN2缺失细胞构建和NSUN2功能研究
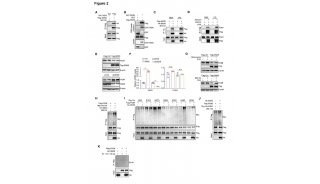
为了探讨NSUN2在肝细胞癌(HepG2)中的功能作用,首先通过基因敲除构建NSUN2缺失的HepG2细胞,以此与野生肝癌细胞对比。通过RT-qPCR和western
blot等反应评估得出,细胞超过90%的NSUN2的基因表达受到抑制,证明缺失株构建成功。
体外生长试验也发现NSUN2基因缺失细胞生存力和细胞克隆能力显著降低;用流式细胞仪分析细胞周期分布发现与野生型细胞相比,NSUN2缺陷型肝癌细胞少量处在G1和S期,更多处于G2和M期,说明缺失NSUN2基因HepG2细胞增殖与分裂受到抑制。

图1
进一步采用伤口愈合试验和Trans-well侵袭试验发现NSUS 2基因缺失导致细胞迁移和增殖能力受限。用肝癌细胞接种裸鼠也发现,接种NSUS 2缺失细胞形成的肿瘤明显小于接种野生型肝癌细胞形成的肿瘤。这些结果与体外结果一致,进一步证实了NSUN2在肝癌细胞的致瘤性中起重要作用。

图2
(2)NSUN2基因缺失细胞RNA表达和m5C修饰表达谱
基于NSUN2缺失后细胞表型的改变,为进一步探索其分子层面的变化,对野生型HepG2和NSUN2缺陷型HepG2进行转录组测序和m5C-Bis-Seq测序。RNA-Seq测序结果分析发现2681个差异表达基因,富集途径大多数与致癌作用有关,包括癌症过程、Rap1信号途径、PI3K-Akt信号途径、癌症中的蛋白聚糖和TGF-β信号途径(图3c)。m5C-Bis-Seq总共鉴定出1208个基因中11788个m5C候选位点在HepG2和NSUN2缺失细胞之间有差异甲基化。KEGG富集分析显示这些DMGs在20种途径中富集,包括剪接体、癌症中的蛋白聚糖、细胞周期、雌激素信号通路等(图3e)。RNA-Seq与m5C-Bis-Seq比较分析后得出,NSUN2缺失,导致包括H19 LncRNA在内的52个lncRNA在m5C甲基化和lncRNA表达方面都有显著变化。

图3
(3)H19 LncRNA是NSUN2的底物
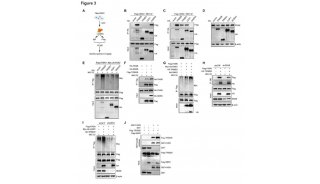
NSUN2缺失后,RT-qPCR验证发现H19的表达下调了至少80%,H19特异性引物的Bisulfite-PCR检测发现H19 RNA
C986位点甲基化完全丧失。而NSUN2的重新表达在一定程度上恢复了H19 LncRNA在NSUN2缺陷型肝癌细胞中的表达和甲基化。

图4
(4)m5C修饰影响H19 RNA的半衰期与稳定性
为进一步验证NSUN2介导H19 LncRNA甲基化是否会影响H19 LncRNA表达水平。研究者使肝癌细胞接受ActD
处理,然后进行RT-qPCR分析H19 RNA半衰期。如图5a所示,H19
RNA的半衰期在NSUN2缺失后显著缩短。此外,在NSUN2缺陷的HepG2细胞中,NSUN2的重新表达在一定程度上恢复了H19
RNA的半衰期(图5b)。与此同时阴性对照显示NSUN2的缺失或重新表达不影响ACT-B基因的半衰期。
此外,m5C位点在调节H19稳定性是使用荧光素酶报告分析来验证的,该分析通过构建含有野生型H19基因片段(H19-Wt)和具有突变m5C位点H19基因片段(H19Mut)的细胞来实现的。不出所料,m5C位点突变显著抑制正常肝癌细胞的荧光素酶活性,但不抑制NSUN2缺陷肝癌细胞的荧光素酶活性(图5c)。H19-Wt的荧光素酶活性在正常HepG2细胞中显著高于NSUN2缺陷型HepG2细胞。因此,这些结果表明NSUN2介导的RNA甲基化可能使H19
LncRNA稳定。
(5)H19表达和m5C修饰与HCC分化有关
接下来,作者测定了55名HCC患者的HCC组织及其癌旁正常组织中H19
RNA的表达和甲基化水平。与癌旁组织相比,H19在HCC组织中的表达显著增加,H19 C986位点的甲基化水平明显升高,此外,H19
RNA水平与其在这些组织中的RNA甲基化水平显著相关(p< 0.01,r= 0.511)(图5f)。
然而在HCC组织和癌旁组织之间,NSUN2 mRNA水平没有显著变化组织(图5g)。当与H19
C986甲基化水平差异超过10%的组织进行比较时,HCC组织中的NSUN2 mRNA水平显著高于癌旁组织(图5h)。表明NSUN2介导的H19
LncRNA的m5C异常修饰与肿瘤分化程度相关。综上所述,我们的发现表明H19的RNA甲基化水平在HCC增加,并与其表达呈正相关,这与恶性HCC病显著相关。

图5
(6)NSUN2介导m5C修饰的H19 LncRNA与癌蛋白G3BP1相互作用
XIST和HOTAIR LncRNAs m5C修饰被证明能调节它们与PRC2的相互作用。
因此,作者猜测m5C修饰的H19 LncRNA可能调节其与其他蛋白质的相互作用。通过使用RNA pulldown-MS技术(云序可提供),分离鉴定到与H19
LncRNA结合蛋白G3BP1。由H19 RNA探针下拉的G3BP1在野生型HepG2细胞中可检测到,但在NSUS
2缺陷型HepG2细胞中检测不到,同时,在野生型HepG2细胞和NSUS
2缺陷型HepG2细胞之间的G3BP1蛋白水平没有显著变化(图6b),表明H19 RNA和G3BP1蛋白之间的相互作用可能受到NSUS
2的影响。使用G3BP1抗体的RNA结合蛋白免疫沉淀RIP-PCR(云序可提供)证实了这一概念(图6c)。G3BP1在野生型HepG2细胞中特异性结合H19
LncRNA,而在NSUS 2缺陷型HepG2细胞中不结合,这一事实表明H19 LncRNA与G3BP1蛋白的相互作用可能依赖于NSUS
2介导的RNA甲基化。用纯化的重组人G3BP1蛋白和H19
RNA探针进行了进一步的rEMSA实验。结果显示G3BP1重组蛋白优先结合m5C修饰的寡核苷酸(图6d),表明G3BP1蛋白和H19
RNA结合受m5C修饰调控。

图6
点评:
文章通过m5C-Bis-Seq结合全转录组测序技术(云序提供),通过对测序结果比对分析筛选到差异的m5C修饰的差异RNA,该方法的优点是两个测序结果取交集缩小差异范围,明确科研检测目标。另外m5C-MeRIP结合RNA pull down实验(云序可提供),正反向验证与RNA特异性结合的蛋白,对深度挖掘不同分子的RNA修饰机制提供可靠的依据。