纳米抗体(Nanobody)研究进展
1993年比利时科学家首次在Nature报道[1]:在骆驼血液中的抗体,有一半没有轻链,而且更让人惊喜的是,这些缺失轻链的“重链抗体” (heavy-chain antibodies, HCAbs)能像正常抗体一样与抗原等靶标紧密结合,另外不像scFv那样互相沾粘,甚至聚集成块。这种抗体只包含一个重链可变区(variable domain of heavy chain of HCAb, VHH)和两个常规的CH2与CH3区,更重要的是单独克隆并表达出来的VHH区具有很好的结构稳定性与抗原结合活性,VHH是目前己知的可结合目标抗原的最小单位,所以VHH也称Nanobody(纳米抗体),现在专门有个公司叫Ablynx (http://www.ablynx.com/)专门从事这种单纳米抗体相关产品的研究与开发。目前已经有两种抗体类药物处于二期临床。
一 纳米抗体的结构特点
Nanobody的结构简单仅仅是骆驼重链可变区[2],如下图C:
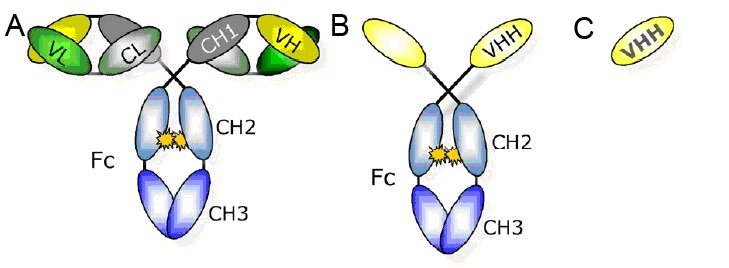
图1 Nanobody结构模式图
A图:传统四链结构的抗体;B图:骆驼血液中的重链抗体;C图:稳定的可结合抗原的最小单位VHH也称 Nanobody
二 传统抗体类药物面临的挑战:
1,开发周期长,生产成本高,药物价格高昂(研发复杂,人源化复杂,成功率有限)
2,难以大规模生产,单克隆抗体药物在建厂和生产过程中消耗的资金非常巨大
3,不稳定,容易降解,保存成本高;容易污染,维护成本高昂。在高温和强酸强碱的条件下会分解,须在低温下保存,否则就会在数周内完全失去活性。抗体能被消化系统很快降解,从而阻止了其进入大脑或其他有效作用部位。
三 Nanobody在合成、操作、吸收和价格方面具有优势:
1,容易获得 (免疫,B淋巴细胞分离,抗体库展示技术筛选)[3]
2,稳定性好 (内部折叠中含有多个二硫键,使其结构具有很好的稳定性,可在常温放置)[4]
3,可溶性高 (不象scFv那样容易聚集成团,VHH亲水性好,具有很好的水溶性,提高作为药物的利用率)
4,吸收好 (因为可溶性高,所以Nanobody具有高吸收率的优点)
5,表达容易 (不象传统抗体那样必须要在哺乳动物细胞中进行表达,难度大,产量低,成本高,VHH可以在原核细胞中进行高效表达,有研究者可将产量提高到2.5g/L)
6,人源化简单 (与人类重链基因同源性在80%-90%,人源化已经取得成功)[5]
7,偶联其他分子容易
参考文献:
1. Hamers-Casterman, C., T. Atarhouch, S. Muyldermans, G. Robinson, C. Hamers, E. B. Songa, N. Bendahman, and R. Hamers. 1993. Naturally occurring antibodies devoid of light chains. Nature 363:446-448.
2. Muyldermans, S., T. N. Baral, V. C. Retamozzo, P. De Baetselier, E. De Genst, J. Kinne, H. Leonhardt, S. Magez, V. K. Nguyen, H. Revets, U. Rothbauer, B. Stijlemans, S. Tillib, U. Wernery, L. Wyns, G. Hassanzadeh-Ghassabeh, and D. Saerens. 2009. Camelid immunoglobulins and nanobody technology. Vet Immunol Immunopathol 128:178-183.
3. Ryckaert, S., E. Pardon, J. Steyaert, and N. Callewaert. 2010. Isolation of antigen-binding camelid heavy chain antibody fragments (nanobodies) from an immune library displayed on the surface of Pichia pastoris. J Biotechnol 145:93-98.
4. Saerens, D., K. Conrath, J. Govaert, and S. Muyldermans. 2008. Disulfide bond introduction for general stabilization of immunoglobulin heavy-chain variable domains. J Mol Biol 377:478-488.
5. Vincke, C., R. Loris, D. Saerens, S. Martinez-Rodriguez, S. Muyldermans, and K. Conrath. 2009. General strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold. J Biol Chem 284:3273-3284.
-
焦点事件

-
科技前沿

-
焦点事件

-
项目成果
-
项目成果
-
焦点事件














