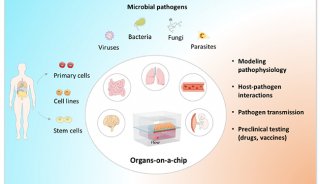
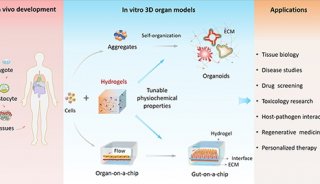
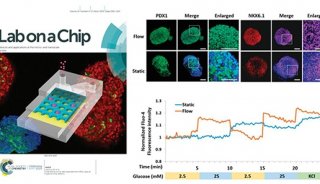
生物医学研究类器官芯片的研究进展
现有的生物医学研究模型主要是细胞系模型和动物模型。细胞系模型是简单、经济、最常见的,但单细胞的细胞生长模式的生长模式缺乏细胞-细胞、细胞-细胞基质间的相互作用,体外培养过程中会丢失细胞的异质性及其在体内的特性,使其无法模拟复杂的三维环境和组织细胞在体内的功能及相关的信号通路。动物模型可以近似于人类生理学,但往往受到成像观察、混淆变量、人类可用性有限以及动物和人类之间生物学差异的限制。
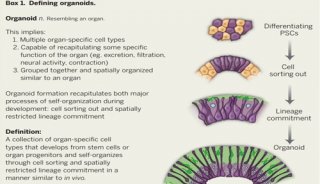
类器官模型的最新发展弥补了这些缺点。有机物是具有干细胞潜能的细胞在体外三维培养后形成的细胞团,具有自我更新和自我组装的能力,其结构和功能与源组织相似。与传统的细胞系模型不同,类器官不仅可以长期继代培养,而且具有稳定的表型和遗传特性。
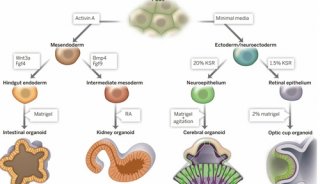
20世纪80年代,研究人员发现哺乳动物细胞具有分化为自身组织的能力。在此基础上,2009年,Sato等人在含有表皮生长因子、Noggin和P-spondin的三维基质凝胶培养系统中培养了来自小鼠肠道的成体干细胞,并形成了类似于小肠的微结构,即隐窝绒毛样复合体,并成功建立了肠道有机物塔培养系统。然后,他们利用该系统培养了一个早期选择的富含亮氨酸的重复G-蛋白偶联受体-5肠干细胞,发现它也可以形成具有上述特殊结构的类器官,并且仍然存在Lgr5肠干细胞。由此可见,在该系统下构建的类器官能够很好地模拟体内小肠的形态结构和功能,并维持干细胞的存在。后来,他们将这种方法扩展到结肠和肿瘤类器官的培养,为类器官的研究打开了大门。目前,国内外学者已成功培养出具有三维结构的结肠、食管、胰腺、肝脏、前列腺和乳腺的类器官以及相应的肿瘤类器官。
类器官的三维培养需要使用生物工程方法来指导细胞分裂和分化。细胞因子和细胞外基质构成了干细胞培养的微环境,是器官更新和分化的物质基础。通过人工调节培养系统的成分,细胞自动分化为特定结构并完成类器官自组装过程。Lancaster等人认为,自组装过程的原理是:(1)同一细胞表面含有相同的粘附蛋白,容易相互粘附;(2) 细胞分化受空间限制,干细胞、分化细胞和上皮细胞的层次结构由深到浅形成。
类器官模型不仅维持了细胞与细胞外基质之间的相互作用,而且还代表了体内的生理条件。此外,它还含有干细胞,可以无限增殖,并能很好地保持细胞的异质性,因此适合大规模的生物医学研究。近年来,为了建立更好的药物筛选平台,研究人员建立了器官芯片。这是一种模拟完整器官结构和功能的微阵列,含有微量化学物质和微生物,模拟将同一物质放入真正的人体器官时发生的情况。
类器官可以长期培养和传代,基因型稳定,复苏后可以冷冻和稳定培养,为建立生物器官库提供了可能。通过扩大类器官生物库,我们可以获得各种类器官模型和肿瘤模型,表达在基因测序和谱分析中,不仅可以在个体层面上做出指导,如疾病易感性和效应预测以及再生医学,可以为大规模实验提供足够的数据支持。类器官芯片以微型结构为特征,高通量和高灵敏度的特点。Emulate Bio所提供的开放灵活的器官芯片平台,它已应用于许多生物学领域,如开发或疾病模型构建、药物开发、免疫反应治疗、微生物感染等。