医疗器械行业2月风向 政策文件逐一揭晓
在2024年2月期间,国家药品监督管理局、医疗器械技术审评中心、国家卫生健康委员会、国家组织医用耗材联合采购平台以及国家标准化管理委员会等多部门,共同或分别出台了一系列关于医疗器械行业的政策法规文件。这些公告和通知涉及了包括创新医疗器械优先审批程序在内的多个重要议题,旨在进一步规范医疗器械市场秩序,推动技术创新与应用,加强产品质量监管,并促进医用耗材集中采购工作的深化实施。同时,各地监管部门也相应发布了配套措施及指导性意见,以确保相关政策的落地执行。
发布机构 | 日期 | 相关文件 |
国家药监局 | 2月1日 | 《中国医疗器械标准管理年报(2023年度) 》 |
2月5日 | 《2023年度医疗器械注册工作报告》 | |
2月19日 | YY1001-2024《全玻璃注射器》等20项医疗器械行业标准 | |
国家卫健委 | 2月8日 | 《关于2023年甲类大型医用设备配置许可结果的通告》 |
2月8日 | 《国家卫生健康委关于调整"十四五"大型医用设备配置规划的通知》 | |
国家药监局器审中心 | 2月5日 | 《关于调整医疗器械注册电子申报信息化系统业务范围的通告》 |
2月6日 | 医疗器械优先审批申请审核结果公示 | |
2月6日 | 《近视弱视用激光设备技术审评要点》 | |
2月6日 | 正电子发射磁共振成像系统等4项医疗器械产品注册审查指导原则 | |
2月7日 | 创新医疗器械特别审查申请审查结果公示 | |
2月28日 | 2024年1月医疗器械技术审评工作情况汇总 | |
2月28日 | 2024 年1月审结转出注册项目审评用时情况 | |
国家组织医用耗材联合采购平台 | 2月5日 | 关于开展人工关节类医用耗材信息集中维护工作的通知 |
2月23日 | 人工关节集中带量采购协议期满接续采购公告(第1号) | |
2月26日 | 关于公示人工关节部件信息的通知 | |
国家标管中心 | 2月19日 | 《2024年全国标准化工作要点》 |
北京市药监局 | 2月1日 | 北京市创新医疗器械产品公示 |
重庆市药监局 | 2月6日 | 重庆市药品监督管理局2023年第一类医疗器械产品备案管理工作综述 |
天津市药监局 | 2月19日 | 天津市第二类创新医疗器械审查认定公示 |
吉林省药监局 | 2月27日 | 关于推进第二第三类高端医疗器械装备项目研发成果转化的通知 |
广东省药监局 | 2月21日 | 创新医疗器械特别审批(广东省第二类) |
陕西省药监局 | 2月1日 | 《陕西省医疗器械生产质量信用等级评定及分类监督管理办法》 |
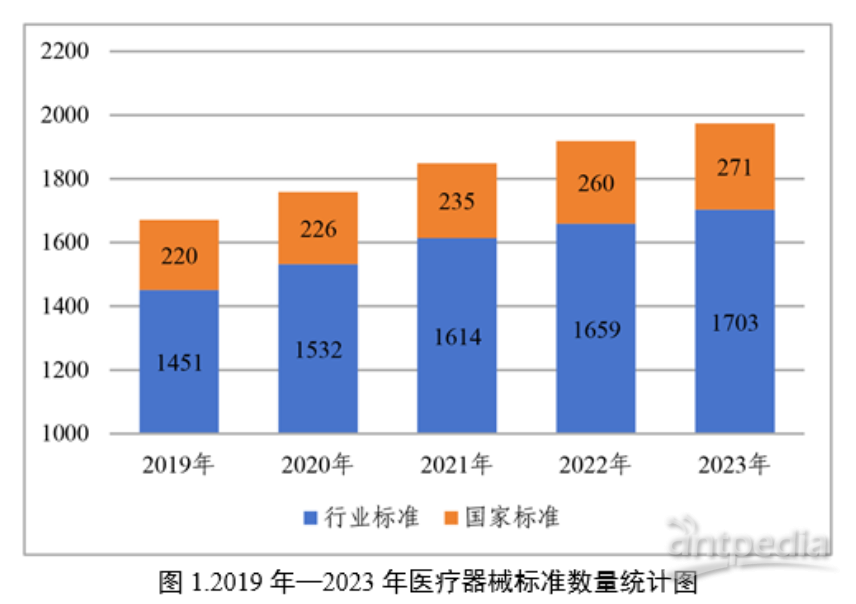
1、2月1日:《中国医疗器械标准管理年报(2023年度)》
截至2023年12月31日,我国现行有效医疗器械标准共计1974项,其中国家标准271项,行业标准1703项。
2、2月5日:《2023年度医疗器械注册工作报告》
2023年,国家药监局依职责共受理医疗器械首次注册、延续注册和变更注册申请共计13260项,与2022年相比增加25.4%。

3、2月19日:YY 1001—2024《全玻璃注射器》等20项医疗器械行业标准
4、2月8日:《关于2023年甲类大型医用设备配置许可结果的通告》
重离子质子放射治疗系统准予许可名单及高端放射治疗类设备准予许可名单。

5、2月8日:《国家卫生健康委关于调整“十四五”大型医用设备配置规划的通知》
“十四五”期间,全国重离子质子放射治疗系统配置规划数新增8台(套),专门用于社会办医疗机构,分年度实施,准入标准不变。

6、2月5日:《关于调整医疗器械注册电子申报信息化系统业务范围的通告(2024年第7号)》
为进一步指导注册申请人准备电子版资料,我中心制作了自行撤回医疗器械注册申请申报资料电子目录文件夹结构,现予发布。
7、2月6日:医疗器械优先审批申请审核结果公示(2024年第2号)
8、2月6日:《近视弱视用激光设备技术审评要点》
为进一步规范近视弱视用激光设备的管理,国家药监局器审中心组织制订了《近视弱视用激光设备技术审评要点》。
9、2月6日:发布正电子发射磁共振成像系统等4项医疗器械产品注册审查指导原则
为规范部分有源产品的注册申报和技术审评,国家药监局器审中心组织制修定了《正电子发射磁共振成像系统注册审查指导原则》等4项注册审查指导原则。
10、2月7日:创新医疗器械特别审查申请审查结果公示(2024年第2号)
2024年,国家药品监督管理局医疗器械技术审评中心依据《创新医疗器械特别审查程序》的相关规定,对近期提交的创新医疗器械特别审查申请进行了严谨、公正且高效的审查,并于同年第2号公示中正式发布了审查结果。
6、2月28日:2024年1月医疗器械技术审评工作情况汇总
2024年1月,国家药监局器械审评中心完成了对多款医疗器械产品的严格技术审评,并在当月批准注册了321个医疗器械产品。广东等地方局亦核发新的生产许可证。同时,创新医疗器械特别审查程序持续进行,尽管1月份具体审查结果未明确公示,但相关部门保持高效运作,不断推进新品审批及企业许可管理,体现了监管部门对产品质量安全与技术创新的重视。
7、2月28日:2024年1月审结转出注册项目审评用时情况
8、2月,国家组织医用耗材联合采购平台发布多个文件,正式启动人工关节国采续标工作。
9、2月19日:《2024年全国标准化工作要点》
10、北京市药监局
2月1日:北京市创新医疗器械产品公示 (2024年第一期)(2024年第二期)
11、重庆市药监局
2月6日:重庆市药品监督管理局2023年第一类医疗器械产品备案管理工作综述
全年共办结第一类医疗器械备案365个,备案变更176个,不予备案50个,取消备案70个。
12、天津市药监局
2月19日:天津市第二类创新医疗器械审查认定公示(2024年第1期)
13、吉林省药监局
2月27日:关于推进第二第三类高端医疗器械装备项目研发成果转化的通知
14、广东省药监局
2月21日:创新医疗器械特别审批(广东省第二类)
15、陕西省药监局
2月1日:《陕西省医疗器械生产质量信用等级评定及分类监督管理办法》
为加强医疗器械注册人、备案人和生产企业质量信用意识,鼓励自律守信,惩戒违法失信,建立健全信用监管长效监管机制,强化医疗器械生产分级监督管理工作,根据《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《陕西省医疗器械生产分级监督管理办法》等法规和规范性文件规定,制定本办法。