Science:挑战常规!tau蛋白磷酸化起初是为了保护神经元
2016年11月19日/生物谷BIOON/--在一项新的研究中,来自澳大利亚新南威尔士大学(UNSW)和澳大利亚神经科学研究所的研究人员进一步揭示了导致阿尔茨海默病(Alzheimer's disease, AD)的细胞过程,推翻了之前持有的关于这种疾病如何产生的观点,并且为开发能够阻止或延缓它的进展的新治疗方案打开大门。相关研究结果发表在2016年11月18日那期Science期刊上,论文标题为“Site-specific phosphorylation of tau inhibits amyloid-β toxicity in Alzheimer’s mice”。
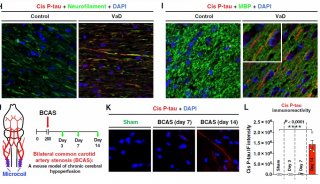
通过研究人大脑组织,研究人员鉴定出一种蛋白,即激酶p38γ,当AD病情进展时,该蛋白会丢失。当他们将这种蛋白重新导入小鼠的大脑中时,它具有抵抗与这种疾病相关联的记忆丧失的保护性效应。
论文共同通信作者、UNSW教授Lars Ittner说,“这项研究完全改变了我们对AD产生期间大脑中发生什么的理解。”
AD的两个典型特征是蛋白斑块(由β-淀粉样蛋白组成)的存在和蛋白缠结(由tau蛋白组成)的存在。这些斑块和缠结的堆积与细胞死亡、大脑萎缩和记忆丧失相关联。
研究人员揭示出这个导致蛋白缠结的过程中的一个关键步骤被误解了。在此之前,科学家们认为形成斑块的蛋白,即β-淀粉样蛋白,导致tau蛋白发生磷酸化修饰,从而导致细胞死亡,以及最终导致AD产生。增加的tau蛋白磷酸化最终导致该蛋白形成缠结。
这项新研究的结果提示着tau蛋白磷酸化起初对神经元具有保护作用,而且β-淀粉样蛋白攻击这种保护功能直到这种功能逐渐丢失。正是处于这个阶段的毒性水平导致神经元破坏和与AD相关联的认知缺陷。
Ittner说,“β-淀粉样蛋白对神经元产生毒性,但是tau磷酸化的第一步实际上是降低这种毒性。”
“这完全是一种全新的观点;tau发生磷酸化修饰的原因实际上是保护神经元免受损伤。”
这项新的研究利用不同的模式小鼠和来自悉尼大脑库(Sydney Brain Bank)的人大脑组织鉴定出一种被称作激酶p38γ的蛋白,该蛋白协助tau发生保护性的磷酸化修饰和干扰β-淀粉样蛋白产生的毒性。
通过研究人大脑组织,Ittner和他的团队发现当AD病情进展时,p38γ会丢失,不过仍有少量p38γ会存在于大脑中。
他说,“我们发现在AD病人大脑中,起初提供保护作用的p38γ会较早地逐渐消失,这提示着保护作用丢失。”
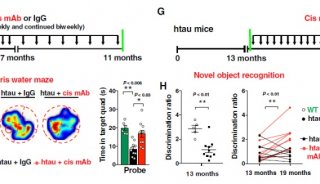
“我们的研究的一部分涉及重新导入p38γ和增加它的活性。我们在小鼠体内观察到,它能够阻止记忆丧失发生,因此它具有真正的治疗潜力。如果我们能够激活这种活性,那么我们可能能够延缓或者甚至阻止AD病情进展。”
当获得新的资金资助的情形下,研究人员的下一步将是利用这些发现开发一种治疗AD病人的新方法。
-
科技前沿

-
项目成果
-
项目成果
-
焦点事件