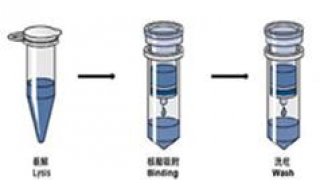
植物总DNA提取方法和过程
植物总DNA提取
植物总 DNA 的提取有多种方法,转基因食品检测中不同用途的 DNA 提取应该采用各自适宜的方法进行。下面介绍用于新鲜或干燥的植物性食品检测的常见 DNA 提取方法。
1、可用于 PCR 的粗提液微量制备
1)原理与特点
利用搅拌破碎食品组织,碱液破坏细胞壁然后再用缓冲液进行提取。此法主要用于用 PCR大量快速检测转基因材料。
2)试剂
0.5mol/L NaOH, 100mmol/L Tris(pH8.0)。
3)方法
(1)称取5~10mg 检测材料,置 Eppendorf 管中,加入5~100μL NaOH,用玻璃棒捣碎,静置片刻。
(2)取 5μL 上清液转入另一个 Eppendorf 管中,加入 Tris 缓冲液至50~500μL,备用。
2、SDS 法提取植物性食品中的 DNA
1)所用试剂
提取缓冲液:100mmol/L Tris·Cl( pH8.0);50mmol/L EDTA( pH8.0); 500mmol/L NaCl,10mmol/L α-巯基乙醇,10%或20%SDS,5mol/L KAc。
2)方法
(1)简易大量粗提取 DNA
①取 25mL 的离心管,加入15mL 提取缓冲液,1mL 10%SDS,混匀,于65℃预热。
②取检测材料4g,置液氮中研磨成粉。
③将冻粉转入上述离心管中,混匀,65℃保温20min,其间摇动1~2次。
④向离心管中加入5mL 5mol/L KAc,混匀,置冰浴中30min。
⑤4℃、12000r/min 离心10min,上清液转入另一离心管中。
⑥加入5mL 氯仿/异戊醇,颠倒离心管混匀,12000r/min 离心5min。
⑦取上清液,加入2/3体积的异丙醇,颠倒离心管混匀,静置至出现絮状物。
⑧挑出絮状物置离心管中,加入适量70%乙醇,轻摇离心管,离心,去上清液,再加入70%乙醇,重复操作2~3次。
⑨沉淀吹干,TE 溶解,备用。
⑩说明:如果对蛋白质杂质要求不高,可省略操作⑥;此法制备的 DNA 可用于 PCR。
(2)小(微)量提取 DNA 及纯化方法
操作:括号内为微量提取时的试剂用量。
①取0.8~1.2g(50~200mg)新鲜植物组织,置液氮中研磨成粉。
②将冻粉大致平均分配到两个15mL(1.5L)的离心管中,各加入提取缓冲液7mL(900μL),轻轻搅动,使粉末充分散开。
③各加入1mL(100L)10%ss,充分混匀,于65℃水浴中保温10~15min(间隔晃动2~3次)。
④各加入1.85mL(160μL)5mol/L KAc,充分混匀,冰浴中放置30min。4℃、12000r/min 离心 15min。
⑤上清液转入新离心管中,加入等体积的氯仿异戊醇,轻轻颠倒离心管数次,放置片刻。4℃、8000r/min 离心 10min。
⑥上清液转入另一离心管中,加入2/3倍体积一20℃预冷的异丙醇,混匀,放置30min,观察 DNA 沉淀生成。
⑦于4℃、8000r/min 离心 10min,倒去上清液将离心管倒置于吸水纸上,控干上清液。
⑧用80%的乙醇洗涤沉淀,吹干10~15min。
⑨加入500μL(100μL)TE缓冲液充分溶解沉淀(若溶解不好,可置37℃水浴中保温,促进溶解)。将溶液转入 Eppendorf 管中,加入1μL RNase 酶液,于37℃保温 1h。
⑩加入等体积酚/氯仿,混匀,室温放置10mi,4℃、8000r/min 离心 5min。将上清液转移到新的离心管中,重复此操作。
⑪转移上清液于新离心管中,加入等体积的氯仿/异戊醇,轻缓倒管混匀,室温放置几1分钟后,10000r/min 离心 5min。
⑫转移并量出上清液体积,置新离心管中,加入3mol/L NaAc,使其终浓度为0.3mol/L(也可以加终浓度为0.2mol/L NaCl 或终浓度为 2.5mol/L 的乙酸铵),混匀,加入2倍体积的无水乙醇,轻缓混匀,室温放置数分钟。10000r/min 离心5~10min,按⑦操作,去尽上清液。用80%乙醇洗涤沉淀2~3次吹干。
④加入50μL(10μL)TE 或蒸馏水溶解 DNA,备用。
注:a.该方法制备的 DNA 可用于限制性酶切、Southern 杂交、RAPD 分析等;
b.用于禾谷类作物总 DNA 提取时,在粗提物用TE溶解后改用低速离心数分钟,去除污染物后加入终浓度为 0.3mol/L 的 NaAc(pH5.2)及0.6倍体积的异丙醇,再次沉淀 DNA,然后用80%的乙醇洗沉淀,吹干,产率可达40~120μg/g 鲜重.所提取的 DNA 可被限制性内切酶消化,但酶切消化时,需加大酶量并反应3~4h;
c.对于马铃薯、番茄等富含多酚类物质的材料,提取缓冲液中Tris的浓度可以减半巯基乙醇的含量应提高。操作中在加入提取缓冲液后需增加在冰冷的条件下加入20% PVP 至终浓度为6%,PVP 能与多酚类物质结合,经离心后除去。SDS的用量应提高,可加入20% SDS至终浓度为2%。