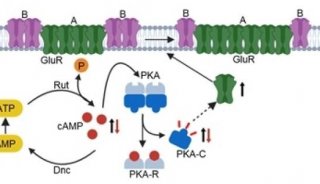
脑内LTCCs在药物成瘾形成过程中的调控机制
药物成瘾伴随中枢神经系统内钙离子通道数目及开放状态的适应性改变. 大量证据表明, L型电压依赖性钙通道(LTCCs)可通过调节神经递质的释放、神经兴奋性、基因的转录及突触可塑性等过程调控成瘾行为. 最新的研究还表明, LTCCs的不同亚型Cav1.2和Cav1.3对药物成瘾的调控分别依赖于D1及D2受体, 且具有脑区及分子机制特异性. 并且, Cav1.3的亚基能够与内质网钙通道蛋白(RyR2)的N末端氨基酸相互结合, 促进胞内钙库Ca2+的释放. 此外, 骨架蛋白激酶A锚定蛋白79/150(AKAP79/150)可将LTCCs锚定在突触膜上, 从而调控成瘾药物诱导的突触可塑性改变. 来自中国科学院心理研究所等处的研究人员近期重点讨论了LTCCs在药物成瘾中发挥的调控作用及其潜在的细胞及分子机制.
细胞内游离Ca2+浓度的改变是细胞生理功能的重要物质基础, 如神经递质的释放、荷尔蒙的分泌, 也是多种胞内信号传导以及基因表达过程的关键环节. 近年来, 除了N-甲基-D-天冬氨酸受体(N-methyl -D-aspartic acid receptor, NMDAR)这种配体门控的钙离子通道, 电压门控型钙通道(voltage dependent calcium channels, VDCCs)与药物成瘾间的关系正受到日益广泛的关注. 与NMDAR引起Ca2+内流的机制不同, VDCCs是通过细胞膜的去极化激活从而介导Ca2+的内流.
分子生物学研究已经发现10种不同的基因能够编码不同的α1亚基, 因此研究者根据α1亚基序列的相似性将VDCCs分为不同的家族——Cav1, Cav2以及Cav3. Cav1亚型相当于L型VDCCs(L-type voltage dependent calcium channels, LTCCs), Cav2构成R型、N型及P/Q型VDCCs, 而Cav3组成T型通道. 所有类型的VDCCs在中枢神经系统中均有表达, 但是他们在生理过程中的角色却各不相同.
据报道, 在吗啡慢性给药过程中, 伴随LTCCs通道数目和开放状态的改变, 成瘾相关脑区如海马胞内Ca2+的浓度也相应改变, 且Cav1.3的亚基能够通过与内质网钙通道蛋白(ryanodine receptor 2, RyR2)受体N末端连接促进胞内钙库进一步释放Ca2+, 从而形成对成瘾药物的依赖和耐受. 近期研究还发现, 成瘾药物敏化行为中, Cav1.2和Cav1.3发挥的作用具有脑区及分子机制特异性, 例如, Cav1.3特异性调节可卡因和安非他明诱导行为敏化的获得, 而Cav1.2选择性参与敏化行为的表达; 伏隔核(nucleus accumbens, NAc)内Cav1.2的通道开放依赖于D1受体,开放后的钙通道使Ca2+内流同时激活钙/钙调素依赖性蛋白激酶(calcium/calmodulin-dependent protein kinase, CaMK), 最终磷酸化GluA1的Ser831位点并诱导GluA1的插膜, 而背侧纹状体(dorsal striatum, DS)内Cav1.3通道的开放则依赖于D2受体.
另外,骨架蛋白激酶A锚定蛋白79/150(A-kinase anchor proteins, AKAP79/150)可将LTCCs锚定于突触膜上, 这种LTCCs功能区域的改变直接影响了可卡因觅药行为的重建. 此外, LTCCs依赖的突触可塑性, 即神经元长时程增强(long-term potentiation, LTP)和长时程抑制(long-term depression, LTD)的诱导和维持也是成瘾记忆形成和发展的必要条件之一.
这篇文章概述了LTCCs在药物成瘾形成和发展过程中的作用, 及其参与调控成瘾记忆的内在分子基础, 为进一步探索成瘾记忆的神经生物学机制拓展视角
-
项目成果