液体活检助力消化道肿瘤诊疗
液体活检是近几年来兴起的一种分子检测手段,可以帮助临床医生早期筛查和发现肿瘤,为肿瘤的早期诊断提供了一种比常规肿瘤标志物灵敏性及特异性更高的替代方法。同时,液体活检还具有实时监测治疗疗效和耐药基因的产生,评估复发转移风险的作用,在肿瘤的精准治疗中具有重要临床应用前景。本文主要对液体活检的生物学特性及其在消化道肿瘤中的临床应用进行概述。

2018年全球癌症统计数据显示,全球新发肿瘤的发病率排名中,结直肠癌排名第三位,占10.2%;胃癌排名第五位,占5.7%;全球肿瘤死亡率中,结直肠癌排名第二位,占9.2%;胃癌、肝癌并列第三位,分别占8.2%[1]。在我国,胃癌、肝癌、食道癌等消化道肿瘤占所有肿瘤发病率的50%,死亡率占36.4%。目前消化道肿瘤的诊断依靠医学影像学技术、血清肿瘤标志物和组织活检等方式。影像学检查常常滞后于疾病发生,并且无法判断微小病灶。血清肿瘤标志物(如CEA、CA-199等)的敏感性、特异性有限。组织学活检虽是诊断“金标准”,但对人体创伤大,患者依从性差,无法动态监测。因此,寻找特异度及灵敏度高、患者耐受性好的检查方法至关重要。
液体活检是对体液(血液、唾液、脑脊液或尿液)中的物质进行分析,循环肿瘤细胞、循环肿瘤DNA和外泌体等[2]是目前的主要检测项目。液体活检技术具有非侵袭性、可动态观察、操作简单等特点,在肿瘤的临床分期、疗效及预后判断、个体化化诊疗中发挥了巨大作用。
1 液体活检的生物学基础
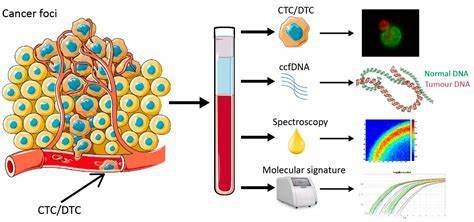
1.1 循环肿瘤细胞
循环肿瘤细胞(circulating tumor cells,CTCs)是指从实体肿瘤上自然脱落后进入到血液中的癌细胞,可以单个存在也可以聚集成团。循环肿瘤细胞最早由Ashworth教授于1869年在一位癌症患者血液中通过与其他肿瘤细胞形态学进行比较而发现的[3]。虽然CTCs的发现有150多年历史,但由于当时技术原因,直到近二十多年,CTCs才得到广泛关注。血液中的CTCs数量极少, 每109个血液细胞中只有1~10个CTCs[4]。因此在检测CTCs前需要进行富集,目前的富集方法主要有免疫磁珠分离技术、密度梯度离心技术和基于肿瘤细胞大小的分离法[5-6]。但对于同一癌肿,各富集方式的结果也各不相同。因此,在临床实施前需要进一步细化和标准化。
1.2 循环肿瘤DNA
循环肿瘤DNA(circulating tumor DNA,ctDNA)通常是指肿瘤细胞凋亡后进入外周血循环的游离核酸,一般由70~200个碱基对组成[7]。1994年,首次在游离DNA中发现突变的KRAS基因,并证明了外周血中的突变DNA片段来源于肿瘤[8]。并且,有研究证明外周血中ctDNA数量与肿瘤负荷成正比[9]。ctDNA的半衰期时间很短,一般在15 min至2.5 h,然后被肝脏或肾脏代谢清除,因此,快速的清除时间使得临床医生只能对短短几小时而不是几周的肿瘤进行评估[10-11]。目前ctDNA的检测方式主要有两大类,一类是基于聚合酶链式反应(polymerase chain reaction PCR)技术,其敏感性较高,但只能检测已知的突变位点。另一类是基于二代测序(next generation sequencing,NGS)技术,可检测未知突变,但检测过程复杂,成本高,耗时长[12]。
1.3 外泌体
外泌体(exosome)是一种纳米大小的微囊泡(直径30~100 nm),是由晚期多囊泡膜向内出芽将细胞内物质包裹,与质膜融合后,外泌体被分泌到细胞外,迁移到远处,甚至跨越生理屏障,如血脑屏障。1986年,Johnstone在绵羊红细胞中发现了外泌体的存在。随着研究的不断深入,科学家们发现其内富含蛋白质、核酸、脂质等生物活性物质,是参与细胞间物质交换、信号传导的重要媒介。外泌体的生物学效应主要包括呈递抗原、免疫调控、损伤组织修复等。研究表明,从肿瘤细胞中脱落的外泌体(TEXs)可作用于上皮细胞,促使肿瘤转移[13],另外,它还能下调NK细胞的活性,诱导免疫逃逸[14]。
2 液体活检在消化道肿瘤诊疗中的应用
2.1 液体活检在消化道肿瘤早期筛查及诊断中的作用
利用液体活检对消化道肿瘤进行筛查诊断和疾病复发评估已成为目前的热门研究。ctDNA作为液体活检中的一部分,在早期诊断中有着重要作用。ctDNA在血液中的含量较少,导致ctDNA检测的阳性率低。Molparia等[15]在一项研究中通过细胞游离DNA测序(cell free DNA sequencing)检测大规模体细胞拷贝数变异(CNV),与点突变检测相比,CNV检测检出率更高。将25名早期结直肠癌患者作为实验组和24名健康者作为对照组进行CNV检测,区分实验组和对照组的特异性达到100%、敏感性达到79%。Bettegowda等[16]使用dPCR技术对640例不同癌肿患者进行ctDNA检测,分别有73%、57%、48%的非转移性结直肠癌、胃食管癌、胰腺癌患者血液中检测到ctDNA。Cohen等[17]也通过同样的方法对221例早期胰腺癌患者进行ctDNA检测,66例患者的血中检测出KRAS基因突变,敏感性为30%,考虑ctDNA检测在胰腺癌中敏感性较低,Cohen学者进一步探究KRAS基因结合CA199是否能提高单独KRAS基因检测的敏感性,结果发现KRAS基因结合CA199组的敏感性提高到了64%,在对照组中只有1例检测到了KRAS基因突变或CA199阳性,特异性为99.5%。因此,ctDNA检测在大多数消化道肿瘤中的特异性和敏感性较高,可作为消化道肿瘤早期筛查和诊断的一种手段。ctDNA检测联合蛋白生物标志物检测可以提高检测灵敏度。
近年来外泌体作为一种新型肿瘤标志物得到了研究者的广泛关注。最新的一项研究采用免疫印迹试验方法对92例结直肠癌患者和32例健康对照者的外泌体来源的CPNE3蛋白含量进行检测,发现结直肠癌患者CPNE3蛋白表达明显高于正常对照组,并且Ⅲ~Ⅳ期患者CPNE3蛋白的表达高于Ⅰ~Ⅱ期患者。研究者进一步绘制ROC曲线将CPNE3与常规肿瘤标志物CEA进行比较,发现CPNE3的AUC值为0.791,其对结直肠癌检测的敏感性和特异性为67.4%、84.4%。而CEA的AUC值为0.728,其对结直肠癌检测的敏感性和特异性为54.3%、93.7%。当CPNE3联合CEA时,对结直肠癌检测的敏感性和特异性为81.2%、84.8%[18]。由此可见,CPNE3的灵敏度较高可用于结直肠癌的早期诊断及分期;将外泌体与蛋白生物标志物检测可以提高灵敏度及特异性,从而提高诊断的准确性。综上,利用液体活检技术可早期筛查和诊断消化道肿瘤,值得临床推广。
2.2 液体活检在消化道肿瘤治疗效果评价中的作用
液体活检不仅可以早期筛查和诊断消化道肿瘤,同时也可以评价治疗效果,指导临床用药。Chen等[19]收集了65例食管癌患者,对39例局部晚期不能直接手术的食管癌患者进行了2周期术前新辅助化疗,化疗前及每周期化疗后2~3周内分别检测CTCs,以RECIST1.1版进行评效。达到完全缓解(complete response, CR)或部分缓解(progressive disease, PR)的患者中多次(2~3次)检测CTC阳性的频率为31.8%,疾病稳定(stable disease, SD)或疾病进展(progressive disease, PD)的患者多次(2~3次)检测CTC阳性的频率为70.6%(P=0.03)。对26名早期食管癌单纯手术患者进行术前及术后CTCs检测,发现术后CTCs明显下降(P=0.037)。国内研究也同样证明了局部晚期食管癌新辅助放化疗后CTC仍然阳性的患者较CTC转阴的患者中位生存时间短[20]。一项前瞻性的研究纳入了82名转移性结直肠癌患者,在一线或二线化疗的第一、三周期化疗前采血检测ctDNA,发现化疗后ctDNA浓度下降组较上升组无进展生存时间(progression-free survival, PFS)和总生存时间(overall survival, OS)长[21]。多项研究表明在转移性结直肠癌中,ctDNA浓度随着化疗有效和获得耐药而升高、降低[22-23]。ctDNA在胰腺癌中的研究也有类似的发现,ctDNA的变化与CA19-9水平、疾病进展密切相关[24-25]。这表明ctDNA的动态监测可能成为血液肿瘤标志物测定的一种替代方法。ctDNA不仅能检测药物反应还可以检测耐药基因。在药物治疗过程中,由于肿瘤微环境改变、肿瘤异质性等多种原因可引起肿瘤细胞耐药。ctDNA检测RAS、BRAF和EGFR耐药相关突变具有很高的敏感性[26-27]。Helden等[27]对接受三线西妥西单抗治疗的晚期结直肠癌患者的ctDNA进行分析,发现治疗2周期时有病灶缩小的患者血液中的ctDNA数量明显减少,而出现疾病进展时BRAF或NRAS突变总数较基线时明显增加。Knebel等[28]发现在治疗KRAS野生型晚期结直肠癌期间使用ctDNA监测到KRAS抗性突变可以比影像学发现疾病进展早2个月。王蕾[29]的研究也同样证实了实时液体活检可以监控耐药基因的变化,且明显早于影像学评估疾病进展。由此可见,除了目前常用的肿瘤标志物外,液体活检技术也可以作为治疗疗效的监测手段之一,同时可以检测耐药基因的出现,及时调整后续治疗手段,进一步做到精准治疗。
2.3 液体活检在消化道肿瘤预后评价中的作用
液体活检与肿瘤负荷有着密切的联系,通过液体活检可以筛选有高复发风险的患者,也可以了解疾病进展和预后情况,目前的研究已表明液体活检作为评估胃肠道肿瘤预后工具有巨大价值[25, 30-31]。
一项包含了2363名非转移性结直肠癌患者的荟萃分析结果显示,CTCs与无病生存时间(disease-free survival, DFS)和总生存时间显著相关[32]。Herbst等[33]对467例转移性结直肠癌患者进行研究,检测甲基化HPP1对预后的影响,发现转移性结直肠癌患者血清中甲基化HPP1存在与疾病进展和总生存时间缩短有关。这一结果与Tham等[34]的一致,通过对Ⅰ~Ⅲ期结直肠癌患者的甲基化TAC1和SEPT9进行检测,证实了甲基化TAC1和SEPT9是肿瘤复发的独立预测因素,且较CEA特异性及灵敏性高。最近一项研究表明,与CEA相比,ctDNA中的两个及以上基因能够检测到两倍的复发患者[35],同样证实了ctDNA对疾病复发的监测比CEA更敏感。Yao等[36]指出,ctDNA中的基因突变状态可以作为转移性结直肠癌预后指标。液体活检在胃癌中也同样具有评价预后的作用[37-39]。Liu等[38]对晚期胃癌化疗患者进行研究,发现化疗后CTCs计数升高患者组比CTCs降低患者组的PFS及OS短,且基线CTCs计数>2是PFS和OS的独立不良预后指标。此外,CTCs数目还与局部淋巴结转移、神经纤维浸润、肿瘤浸润深度有关[39]。CTCs中的存活蛋白(Survivin)表达已被证明可以作为胃癌预后的独立因素[40-41]。Cao等[40]在对98例接受过胃癌根治性切除术的患者的研究中发现,术后存活蛋白表达程度与肿瘤浸润深度、大小及淋巴结转移数量有关。2013年的一项荟萃分析(包括16项研究和1365名患者)也指出存活蛋白表达与胃癌患者预后不良有关[41]。但有趣的是,只有细胞质中的存活蛋白表达对总生存率有显著影响,而细胞核中的表达对预后无影响。因此,通过监测基因的改变能够很好的提示疾病发展情况,并且可以比影像学更早预测肿瘤复发,降低疾病复发率。
3 小结
液体活检是一项基于体液的检测技术,在癌症诊疗中有着广泛的应用价值。液体活检的主要优势包括对肿瘤突变部位进行基因分型、监测治疗反应、揭示耐药性和实时选择治疗方案的实用性。液体活检的高特异性,以及血液的同质性,使其成为现代肿瘤研究中不可或缺的工具。目前液体活检仍面临巨大困难,首先,应该寻找灵敏性和特异性更高的检测方式;其次,应规范检测流程,包括样本取材方式,运输及保存方式以及检测方式。最后,还需要更多大样本、多中心、大规模前瞻性临床研究证实液体活检对临床诊疗的作用。相信在不久的将来,液体活检能够广泛应用于临床,为患者提供更加及时、精准的个体化治疗方案。
参考文献
顾心怡, 李贺明, 王喆, 等. 液体活检在消化道肿瘤诊疗中应用的研究现状. 大连医科大学学报, 2020, 42(1): 76-80. DOI: 10.11724/jdmu.2020.01.16.
-
企业风采

-
市场商机
-
科技前沿
-
科技前沿

-
产品技术

-
产品技术

-
项目成果















