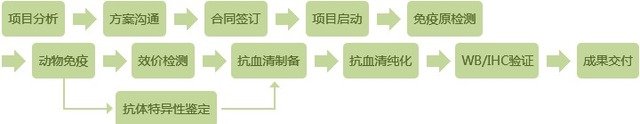
抗血清的制备方法和过程
1、动物的选择
羊、马、鸡、猴、豚鼠,都是常用的免疫动物,在实验中,选择动物时应考虑抗原与动物的种属关系、抗原性质与动物种类、免疫血清的需要量、免疫血清的要求以及动物个体等因素。免疫用动物应选适龄、健壮.最好为雄性。最常用的实验动物是家兔,一般选择选择年龄在6个月以上当年繁殖的♂性,体重2 ~3公斤,健康家兔三只,免疫前用金属编号牌固定兔耳,或用染料涂沫在动物的背部,作出明确的标记。
2、抗原制备
1)抗原稀释:用灭菌生理盐水将抗原稀释为2mg/ml,于免疫前一天加入溶液,使每毫升抗原溶液含青霉素1000 UI,链霉素1000 UI,放4℃过夜(一般可不加青、链霉素)次日取出,与佐剂混合制成乳剂后用于动物免疫。
免疫原的注射剂量应考虑其抗原性的强弱、分子量大小、动物的个体状态和免疫时间。对于纯的可溶性抗原的免疫剂量,通常小鼠首次抗原剂量为50~100μg/次,大鼠为100~200μg/次,兔为100μg ~1 mg/次,合成免疫原为2 mg(半抗原约为20~200μg),一般需要与等量的福氏完全佐剂混合。加强免疫的剂量为首次计量的1/2,通常用不完全福氏佐剂或不用佐剂。如需制备高度特异性的抗血清,可选用低剂量抗原短程免疫法;反之,欲获得高效价的抗血清,宜采用大剂量抗原长程免疫法。
2)佐剂和抗原乳剂的配制
1佐剂的配制:福氏完全佐剂(Freund’s complete adjuvant),各实验室的配方不尽相同,我室采用的配方如下:
医用液体石腊 20毫升
羊毛脂 12克
水浴溶化、混匀,分装于青霉素小瓶,用纱布、线绳扎紧瓶塞。8磅20分钟灭菌,4℃保存备用。于免疫前准备抗原乳剂制备时,以活卡介苗(有时亦用死卡介苗)代替死结核菌,每毫升试剂中加入10mg活卡,即为福氏完全佐剂。
2抗原乳剂的制备:其方法一般有两种,其一,将等量的完全佐剂(注意佐剂必须预先加热融化,但不超过50℃)和抗原溶液分别吸入两个5ml注射器内,在两个注射器的12# 针头间套上一根长约8~12cm的医用无毒塑料管,将两个注射器连接在一起(塑料管必须先经酒精浸泡消毒,使用时取出,用灭菌生理盐水冲洗后,与注射器针头相连接,塑料管与针头的口径须合适,不能松,稍紧些为宜),针头插进塑料管约1~2cm然后由两人相对而坐后缓缓推动针蕊,使管内溶液进入塑料管道至对侧注射器内,每次推动针蕊时必须把管内容物全部推出,另一侧也同样操作,使管内液体往返混合,直至形成油包水乳剂(Water-in-oil enulsion)为止。
其二是,将等量的佐剂和抗原溶液倒入钵内,经过反复碾磨,也可形成油包水乳剂,该法主要优点是快速,可靠,不足方面主要是由于粘附过多,浪费佐剂及抗原。
制成的乳剂是否形成油包水乳剂直接影响免疫效果,因此,必须进行质量检查,检查的方法是将制成的乳剂滴一滴在凉水(自来水)表面,质量合格的乳剂滴入水面保持滴珠完整而不分散,不合格者进入水面后立即扩散,水面油亦逐渐扩大,这就必须要继续操作至质量合格为止。
但有时,由于佐剂的配制质量原因,很难乳化至合格,遇有这种情况,须考虑重新配制佐剂。
3、免疫途径,剂量和免疫周期
抗原注射途径可根据不同抗原及试验要求,选用皮内、皮下、肌肉、静脉或淋巴结内等不同途径注入抗原进行免疫。一般常采用背部、足掌·耳后等处皮内或皮下多点注射。初次免疫与第二次免疫的间隔时间多为2~4周。常规免疫方案为抗原加CFA皮下多点注射进行基础免疫;再以免疫原加IFA作2~5次加强免疫,每次间隔2~3周,皮下或腹腔注射加强免疫。
1)常规(皮内多点注射)免疫:
1第一次免疫:剂量为每只兔子注射1.0 ml抗原乳剂(含抗原量1~2mg)。注射部位为两只后脚掌的皮内各注射0.2 ml,其余0.6 ml分多点注入脊柱二侧,颈部,腹股沟和腋窝等处淋巴结附近部位皮内,每点可注入0.05ml,分12点注入。
2第二次免疫:初次免疫后20天左右,剂量为1.0ml/只(1~2 mg/ml),加福氏不完全佐剂。注射部位在腹部皮下多点注射,每点注入0.1 ml。
3第三次免疫:再次免疫后两周内进行,注射剂量和部位同第二次免疫,免疫后7~14d抽取少许静脉血,分离血清,试血测定效价。
2)淋巴结免疫:主要优点是可减少用量。过程如下:
1卡价苗致敏:免疫前足掌皮下每侧各注入活卡价苗(75 mg/ml)0.3 ml。10天左右观察两侧腘窝淋巴结,一般可肿胀如蚕豆大小,此时即可进行淋巴结内免疫注射。
2第一次免疫:用手指定淋巴结后在两侧腘窝淋巴结内各注入抗原乳剂0.25ml,每只兔总量0.5 ml;为加强免疫,于初次免疫20天后,于腹部皮下多点注射不加佐剂抗原溶液1mg/1ml。
3二周后可如同第一次免疫的剂量和途径再注射一次,一般可在第三次免疫注射前试血滴定效价,效价如已达到要求可不必进行第三次免疫。
有条件的情况下,免疫后要加强动物饲料管理,如给熟黄豆饲养等。
3)腹腔免疫:一般不必加佐剂,适用于细胞性或颗粒性抗原,而且抗原性较强者,例如用绵羊红细胞免疫家兔或小鼠即可用此法。
4、试血,测定抗体效价
一般在第三次免疫后7~10天即可于兔耳静脉或小鼠尾尖取少量血,分离出血清之后进行试血。
① 环状试验,较为经典的方法,较少采用,如与20μg/ml以下的抗原于30 min内能出现“艹”的沉淀环,即测定抗体效价达1:5000以上时为合格。
② 免疫双扩散法,这是最常用的试血方法,其具体方法是,中间孔加稀释的抗原(1mg/ml)10μl,周围孔顺时针方向加制备的抗血清分别为1:2, 1:4, 1:8,1:16,1:32和1:64,(用生理盐水或PBS稀释)。经37℃保温24h后观察结果,效价在1:16以上即可决定放血。
5、放血
经效价检查合格后即可放血。放血前动物应停食12 h,以减少血清中的脂肪含量。如拟保留该免疫动物,可直接由心脏取血,或切开耳缘静脉滴血或心脏穿刺取血。取血后由静脉缓缓注入等量5%葡萄溶液以补足失血量。取血的动物经2~3个月休息,可再次加强免疫后取血。如拟一次放血致死,可用颈动脉放血的方法,各种取血方法如下。
1)心脏取血:固定动物于仰卧位置,用食指探明心脏博动量高部位(在胸骨左侧,由下向上数第3与第4助骨之间,指兔),剪去少许毛,用2.5% 碘酒和75%酒精消毒后,以9#针头在预定位置与胸部呈45。角刺入心脏,微微上下移动针头,待见血液进入针筒后,即将注射器位置固定取血。2.5公斤体重的家兔一次可取血20~30ml。
2)耳缘静脉滴血:先将耳缘静脉附近的毛剪去用无菌棉球将皮肤擦干净(不用酒精消毒,避免溶血)。用台灯照射耳部使血管因温度增高而扩张,然后用无菌刀片将耳缘静脉切一长0.5cm的纵切口,第一次切口应从耳尖部开始,以后再切时,逐步向耳根方向移动。用无菌试管或平皿收集流出的血液。如切口凝血,血流不畅时,可用无菌棉棒轻轻将切口外血凝块擦去(注意勿使切口损伤太大),血流仍可继续流出,直至达到所需要的血量为止。取血后用无菌棉球压迫切口止血。耳缘静脉取血一次可取血50ml左右而动物不死。
3)颈动脉放血:使动物仰卧固定四肢,颈部剪毛、消毒后纵向切开前颈部皮肤长约10cm,用止血钳将皮肤分开夹住,剥离皮下组织,露出肌层,用刀柄加以分离,即见搏动的颈动脉。小心将颈动脉和迷走神经剥离长约5cm,选择血管中段,用止血钳夹住血管壁周围的筋膜。远心端用丝线结扎,近心端用动脉钳夹住,用酒精棉花球消毒血管周围,用无菌剪刀剪一V形缺口。取长2.5cm、直径为1.6mm塑料管一段,将一端剪成针头样斜面,并将此端插入颈动脉中,另一端放入200ml无菌三角瓶内,然后放开止血钳,血即流入三角瓶内,动物流血至死,2.5公斤家兔可放血80~100ml。
6、分离血清
必须在无菌条件下进行,待收集于平皿或三角瓶内的血液凝固之后,用无菌滴管在无菌环境(例如超净工作台)中把血块与瓶壁剥离后,放入37℃,1~2h取出后放入4℃过夜,使血清充分析出(不能冰冻,否则产生溶血),经离心沉淀分出血清,放进低温冰箱保存。使用前必须经过签定合格后再分装保存备用。
7、抗血清的保存
1)经签定合格后的抗血清,以1:100比例加入1%的硫柳汞或5%的叠氮钠,使其最后浓度分别为0.01%或0.05%。
2)用无菌滴管将抗血清分装小管,每管装1ml左右。
3)-20℃以下保存,可保存2年以上。
4)如有条件可将血清冷冻干燥保存于4℃以下,保存时间更久。