上海生科院揭示Cbln家族蛋白功能异同的分子机制
9月5日,中国科学院上海生命科学研究院生物化学与细胞生物学研究所丁建平研究组的最新研究成果以Cbln1 and Cbln4 are structurally similar but differ in GluD2 binding interactions为题发表在Cell Reports上,研究揭示了Cbln1和Cbln4之间功能异同的分子机制。
Cbln家族包含4个成员,它们具有很高的序列同源性和相似的结构组成,均在C端包含一个C1q结构域。有意思的是,Cbln1通过在突触间隙中结合Nrxn蛋白和d-谷氨酸受体参与突触形成。然而,尽管Cbln4与Cbln1有高达74%的序列等同性,文献报道Cbln4不能结合Nrxn蛋白和d-谷氨酸受体,而是DCC的配体。
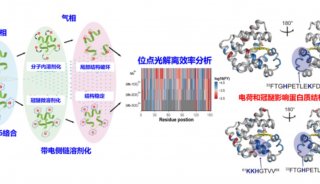
研究人员解析了Cbln1和Cbln4的C1q结构域(Cbln1C1q 和Cbln4C1q)三聚体的晶体结构,分辨率分别为2.2Å和2.3Å。Cbln1C1q和Cbln4C1q总体结构非常相似,但在对应于Cbln1C1q与d-谷氨酸受体2(GluD2)的ATD结构域相互作用界面的区域上有显著不同。利用负染和冷冻电镜单颗粒技术,研究人员获得了分辨率为13Å的全长Cbln1六聚体的三维结构。该结构显示,Cbln1六聚体整体像两个连着的樱桃,Cbln1C1q三聚体占据密度图中的“樱桃”部分,而Cbln1的N端区域形成较平的相互作用界面,介导六聚体的形成。此外,为了解决此前文献中数据有相悖之处的问题,研究人员研发了基于细胞表面结合技术的半定量方法,以测定Cbln1和Cbln4对全长Nrxn1β的亲和力。研究人员发现,Cbln4与全长Nrxn1β的相互作用并不弱,并进一步获得了Cbln4与Nrxn1β的LNS结构域形成的复合物、以及分辨率为19Å的该复合物的三维冷冻电镜结构。结构分析提示,Nrxn1β可能通过其S4片段的β10与Cbln4的N端相结合。这些研究结果揭示了Cbln1和Cbln4之间功能异同的分子机制,为进一步研究Cbln1和Cbln4在神经细胞突触形成中的功能奠定了较好的结构基础。
该研究得到国家自然科学基金委、国家科技部和中科院的资助。
-
项目成果