Nature Methods | 向阳飞等建立功能性血管状系统类脑器官
如果说宇宙蕴藏无数奥秘,那么大脑必定是其中最难解谜团之一。对人类大脑的研究不仅关乎我们对人体内这一最复杂器官发育与功能的理解,相关的病理学、药物发现、再生医学等研究更是与国计民生直接相关。基于干细胞、发育生物学、生物材料等多学科理论与技术的类脑器官近年来发展迅速,为研究人类大脑发育、功能、疾病乃至进化等提供了重要的技术平台。类脑器官一般以多能干细胞(如胚胎干细胞或诱导多能干细胞)为来源,通过三维培养过程,使其能够在体外从时间、空间的维度重构大脑的细胞构成、组织结构与功能。自约六年前类脑器官被首次报道起,全球范围内多个课题组对类脑器官开展了深入地开发、优化研究;同时,类脑器官也被广泛应用于研究多种生物学和医学问题【1,2】。作为一门新兴技术,类脑器官仍有诸多不足尚待改进。其中一个重要的难题即是如何在类脑器官中重构血管系统,从而改善在长期培养过程中类脑器官的发育,并为研究血脑屏障提供支持。
2019年10月7日,来自耶鲁大学干细胞中心In-Hyun Park研究组(Bilal Cakir博士和向阳飞博士为共同一作)在Nature Methods杂志发表了题为Engineering of human brain organoids with a functional vascular-like system的文章,在其前期研究的基础上【3-5】,利用人类胚胎干细胞建立了具有功能性血管状系统的类脑器官(vascularized hCOs; vhCOs),为研究人类大脑发育与疾病提供了重要工具。

该研究中血管状系统的建立基于ETS variant 2 (ETV2)引导的趋血管内皮细胞定向分化。ETV2是血管内皮细胞发育过程中的重要转录因子。研究组首先证明了在多种培养环境下(如拟胚体分化、神经分化及内皮细胞分化),ETV2的高表达均能有效地将人类胚胎干细胞诱导分化为内皮细胞。为研究ETV2的表达能否也在类脑器官中诱导内皮细胞分化、并进一步在类脑器官中形成血管结构,研究团队将可诱导表达ETV2的胚胎干细胞按不同比例加入起始细胞群开展了类脑器官培养,并对ETV2诱导表达时间节点进行了测试。最终在经历大量优化研究后具有血管状结构的类脑器官得以被建立。
对于该系统的鉴定主要集中在两个方面:1)类脑器官中的血管状结构从组织形态和功能上有何特性?2)血管化类脑器官的发育与常规类脑器官相比有何异同?对于前一个问题,首先全组织免疫染色表明血管化类脑器官中形成了CD31阳性的内皮细胞管状结构,且其随着培养时间的延长而形成更为复杂的网络 (图1) 。更多的免疫染色(如CD31与CDH5)及基因表达检测(如CD31、CDH5、TEK、KDR)进一步证明了类脑器官中的内皮细胞分化及血管结构的形成。
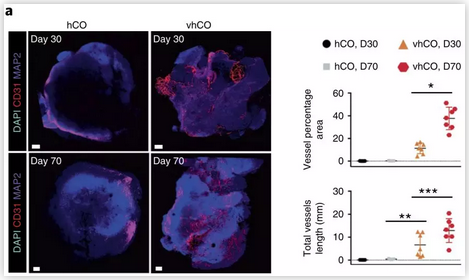
图1 类脑器官全组织免疫染色
其次,类脑器官中的血管化结构能有效灌注异硫氰酸荧光素-葡聚糖(FITC-dextran)(图2),证明了该结构网络的功能性。大脑中血管网络的其中一个重要功能是形成血脑屏障,除血管内皮细胞外,研究组进一步通过对星形胶质细胞、周皮细胞、紧密连结(tight junction)蛋白(α-ZO1、Occludin等)的研究证实血管化类脑器官内能够形成类似血脑屏障的结构,并通过跨内皮细胞电阻(trans-endothelial electrical resistance; TEER)及β淀粉样蛋白(amyloid-β; Aβ)神经毒性模型证明了基于内皮细胞的紧密连结和血脑屏障特性。
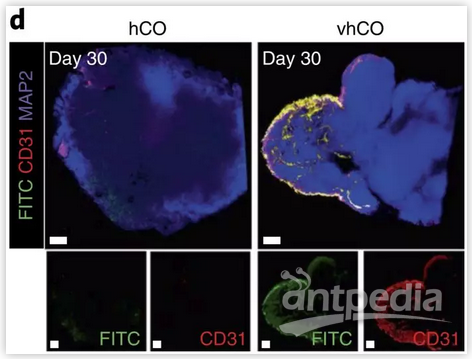
图2 类脑器官FITC灌注及免疫染色
此外,课题组将血管化类脑器官移植入小鼠并开展了核磁共振成像(magnetic resonance imaging; MRI)、FITC -dextran灌注及免疫染色等研究。与2018年Fred Gage课题组的报道一致【6】,移植入体内的对照类脑器官中能生成鼠源的血管结构。与之对比,人源的血管网络仅能在移植的血管化类脑器官中生成并能被FITC-dextran有效灌注 (图3) 。
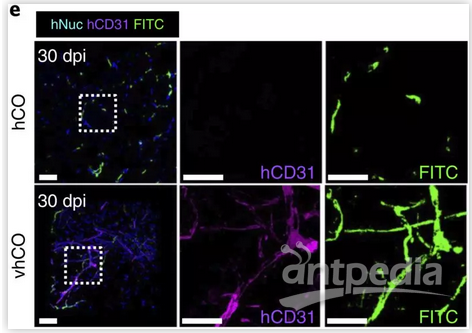
图3 类脑器官的移植与检测
从类脑器官本身的发育角度来看,课题组通过对SOX2阳性的脑室区、CTIP2阳性深层神经元、SATB2阳性浅表层神经元等研究表明,血管化类脑器官和常规类脑器官总体上呈现类似的发育过程。其主要差异表现在经历过长期的培养过程后(如120天),常规类脑器官内部因低氧等因素导致大量细胞死亡,而该现象在血管化类脑器官中得到显著缓解。同时,全细胞膜片钳等检测表明血管化结构的存在能有效促进类脑器官中神经元的功能发育。单细胞转录组学的研究表明血管化类脑器官中内皮细胞群体大量表达血管生成相关基因(如FLT1, HAND1, MME, and VTN)及细胞粘附相关基因等;与人类大脑样本比对分析表明,体外培养70天血管化类脑器官中的神经元接近16~19孕周的人脑样本,而同样时期对照类脑器官中的神经元更接近10~12孕周的人脑样本,从而进一步证明血管化结构有利于类脑器官内的神经成熟。
总之,血管化类脑器官的建立为实现类脑器官的优化培养、促进其功能性成熟,以及为建立体外三维血脑屏障模型提供了新的方案,具有重要的生物学和医学应用潜力。
原文链接:
https://www.nature.com/articles/s41592-019-0586-5
参考文献
1. Lancaster, M.A. and Knoblich, J.A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science 345: 1247125 (2014)
2. Paşca, S.P. Assembling human brain organoids. Science 363:126-127 (2019).
3. Xiang, Y. et al. Fusion of regionally specified hPSC-Derived organoids models human brain development and interneuron migration. Cell Stem Cell 21:383-398.e7 (2017).
4. Xiang, Y. et al. Generation and fusion of human cortical and medial ganglionic eminence brain organoids. Current Protocols in Stem Cell Biology 47. pii: e61. doi: 10.1002/cpsc.61 (2018).
5. Xiang, Y. et al. hESC-derived thalamic organoids form reciprocal projections when fused with cortical organoids. Cell Stem Cell. 24:487-497.e7 (2019).
6. Mansour, AA. et al. An in vivo model of functional and vascularized human brain organoids. Nat Biotechnol 36:432-441 (2018).