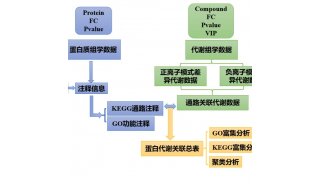
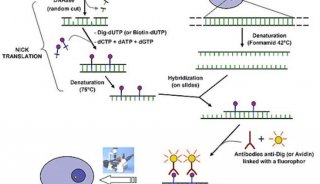
方案8 用 FRET 法分析体内蛋白质的相互作用实验
| 实验材料 | |
|---|---|
| 试剂、试剂盒 | |
| 仪器、耗材 | |
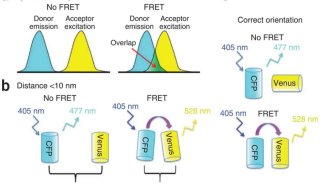
| 实验步骤 | 一、实验设计因为体内 FRET 实验的复杂性,要获得有效的能说明问题的数据,需要满足若干实验准则。详细地了解与实验有关的变化流程,不仅在实验准备阶段,而且对获取图像和数据资料的分析都是非常有用的。关于这方面的讨论见 Gordon 等(1998)。本方案中就采用了这些作者介绍的符号(见表 10.6 和「FRET 数据分析符号含义」)。关于本方案的应用见 Damelin 和 Siver(2000,2002)。 最简单的 FRET 应用是研究两个蛋白质之间的相互关系,目标蛋白质 1 和目标蛋白质 2。其他的外源蛋白质,对照 1、对照 2……,它们不能与目标蛋白 1 相互作用,因而用做阴性对照。正如下面的数据分析和 Gordon 等(1998) 的论述中介绍的那样,体内 FRET 检测法并不是完全绝对的,只有与它类似的测量结果(例如,一对相互作用的蛋白质与一对没有相互作用的蛋白质)进行统计学分析后才有意义。因此,阴性对照的建立是必需的。如能采用多个对照蛋白就更好了,因为更多的数据资料会更有利于结果的分析。对照蛋白质需满足 3 个要求: 1.不会与目标蛋白 1 相互作用; 2.可以与目标蛋白 2 共定位; 3.表达水平与目标蛋白 2 具有可比性。 对照蛋白一般选用其他的外源蛋白,但也有例外情况。例如,如果一个目标蛋白 2 的突变体的表达水平和定位与野生型具有可比性,那么这个突变体就可作为对照蛋白,当然,建议多采用一些除了目标蛋白 1 和目标蛋白 2 之外的蛋白作为对照。 如图 10.30 所示的实验设计,目标蛋白 1 与 CFP 融合,目标蛋白 2 和所有的对照蛋白则与 YFP 融合,在 FRET 滤光镜装置下,大部分信号都由 CFP 产生,因此只有与相同的 CFP 融合蛋白配对,才可以直接进行比较。 二、构建细胞株1.构建用于 CFP 或 YFP 蛋白标记的载体。 对这个实验来说,最合适的是整合型(非复制型)载体,因为其基因组中的外源拷贝被融合基因取代后,可在细胞内得到稳定的表达。载体有 3 个基本的组分:一个酵母选择性标记,如或 URA3, 一个外源基因和 CFP/YFP 之间的内部融合结构,一个 3’端不翻译区段(只对 C 末端融合结构)或一个启动子(只对 N 末端融合结构)。所有的 CFP 载体需带一选择性标记(如 TRP1),而 YFP 载体需带另一选择性标记(如 URA3)0 只需长度较短的外源基因片段,因为它的作用仅为整合;基因组的拷贝可产生大部分的编码序列。因此,对应于每个外源蛋白的基因短片段,便可以通过 PCR 得到扩增,并插入到某一序列盒中,如 pPS1890(CFP) 或 pPS1891(YFP)(DamelinandSilver,2000)。这些序列盒可以在外源蛋白的 C 末端与 CFP/YFP 融合,并在外源启动子的作用下表达融合蛋白。
2.对于每个融合蛋白,用一线性化的载体转化一个野生型的酵母细胞系(在下面的「材料」中介绍),分离几个转化子做进一步分析。 3.在液体培养基中培养转化子(SC 或 drop-mit) 至对数生长期,在显微镜下检测融合蛋白的表达和定位。 4.用整个细胞的提取物作阳性转化子的 Western 印迹分析,选用 a-GFP 抗体进行标记,以确定全长融合蛋白的表达。 5.通过在需要融合蛋白的情况下对细胞活力、融合蛋白的表达及融合蛋白的确切定位,来确定每种融合蛋白的功能。 例如在一些研究中,由于 Nup82 对于细胞生长是必需的,因此 Nup82P-YFP 在野生型细胞中分析;而 Nupl88p-YFP 则在 nupl70A 细胞中进行分析,因为这个遗传背景下 Nupl88 才是必需的(Damelin 和 Silver,2000)’。 6.如果是功能型的融合蛋白,则需制备双标记的细胞株用于 FRET 实验。例如,通过用每种 YFP 构成物转化目标蛋白 I-CFP 细胞株,重复步骤③和④,以确保融合蛋白的共表达。 7.加入甘油,一 80°C 保存细胞株,用于进一步分析。 三、赚光条件的校准对于所有含同样的目标蛋白-CFP 蛋白融合的细胞株,采集其图像信息时,每一种滤光片使用的曝光条件都必须一样,而在 3 组滤光片之间采用的曝光条件可以不同。 8.制备样品,用 SC 培养基,在室温或 25°C,将细胞培养至对数期。 9.按下面的顺序获得双标记细胞株的样品图像。 (1)FRET 滤光片装置; (2)YFP 滤光片装置; (3)CFP 滤光片装置,最大程度减小光漂白效应。 10.通过调整软件和硬件的参数,选择最合适的曝光条件,尤其要注意曝光时间。 应尽可能地缩短曝光时间,以最大程度减少光漂白和光破坏效应。但得出的图像不仅要达到足够强度的背景信号,而且也必须能经得起分析检验(例如,可以对细胞中所需区域进行选择性检验,并可用软件程序对其进行分析)。许多软件包都可以将图像按比例进行缩放,从而在不改动真实数据资料的情况下,改变图像的视觉效果。这样曝光时间就可以较短。 11.取 20 样品滴在玻璃片上,从一侧轻轻地盖上盖玻片,立即镜检。 盖玻片必须与物镜相配套,一般采用 1.5 号盖玻片。
曝光条件的设定,取决于实验设备和融合蛋白的表达水平。因此,不同的目标蛋白,可能需要设定不同的曝光条件。只有在对数据资料直接进行比对的实验中,曝光条件才必须是相同的。 四、图像的采集图像采集最关键的两个方面,一是保持相同的曝光条件;二是每个细胞都使用相同的曝光顺序,从 3 套滤光片装置采集的图像信息,记录了所有可能用到的信息,并且可以在不同的水平上进行分析,如下文所述或参考 Gordon 等(1998)。若有相应的软件,就可以方便地通过使用宏来采集一个细胞中 3 个曝光条件(FRET, 而后 YFP,再 CFP) 下的图片信息,这 3 个条件均是根据上述「曝光条件的校准」而设定的最佳曝光条件。由于需要切换滤光片装置,所以在两次曝光之间,会有一段必要的延迟时间,因此分析只含有一个细胞的图像是最简单的。无论是只限定于一个中心区域内一个小框的图像采集,还是一个较大区段中一个较小的亚区域的图像采集,均需要分开各自保存。 CFP 和 YFP 极易发生光漂白反应,必须采取某种预防措施,最大程度地减小这种效应,在没开始采集图像之前,勿使细胞暴露在荧光下,因为仅几秒钟的照射,便会导致剧烈的光漂白反应。因此,应用白炽灯(相当于荧光灯),找到并锁定每一个细胞。一般地每张片子上只采集 4~5 个细胞的图像,且它们分布于玻片的不同区域。 分析时,每个细胞株所要用到的细胞数目,取决于特定的实验条件,而且可能难以预先决定,开始时,每个细胞株可以采集 20 个细胞的图像信息,这包括两种融合蛋白共表达的细胞,也易于分析检测。 12.采集所有滤光片装置的空白区域图像信息,以检测背景水平。 13.使用所有滤光片装置采集表达目标蛋白 I-CFP 的细胞图像,确定 PW、Dd 和值(见 Gordon,etal,1998; 表 10.6 以及「FRET 数据分析符号含义」)。按步骤⑧?? 准备样品。 大多数情况下,按上述方法测得的 CFP 的 Ad 值为 0。 14.使用所有滤光片装置采集表达目标蛋白 I-CFP 的细胞图像,确定 Fa、Da 和 Aa 值。这些数据由荧光基团和实验条件决定,而与细胞株系无关。因此,这一步对表达 YFP 融合蛋白的所有株系只做一次就行了。 在大多数情况下,对 YFP 而言,采用上述的滤光片装置,Da 的值为0。 15.使用所有滤光片装置采集双标记的细胞株图像。 五、数据资料分析
16.打开某一个细胞对应的 FRET、YFP 和 CFP 滤光片装置获取的图像。 17.选定一个特定区域进行分析,三张图像所选择的区域面积应该具有可比性,可以通过软件设定,并用肉眼确定。 图像分析软件中,有些功能可达到这一要求,例如,有一项功能可通过像素密度(「阈值」)来选择某一区域,还有一项功能,则可人工将一个图像切下,并复制到其他图像上去。 18.记录(用 text 路径或 speadsheet 路径)每张图像所选择区域的平均像素密度。 19.重复步骤16~18,处理剩下的每一个细胞,为了便于做 spreadsheet 分析,按顺序记录每个细胞的 FRET、YFP 和 CFP 图像。 20.对每张背景图像(如从步骤12获得)来说,记录一小块图像中心的平均密度。 21.在 spreadsheet 应用程序中打开数据资料。 22.通过计算每一个滤光片装置中所有背景图像的平均值来确定相应的背景信号。 23.从细胞数据(也就是步骤13~15获得的数据)中减掉背景值。以下的计算就使用了去除背景的值。 24.通过计算的平均比率,来确定 CFP 株系的 Pd/Dd 值。在步骤26中,这个平均值可以认为是一定值。 25.通过计算 Fa/Aa 的平均比率,来确定 YFP 株系的 Fa/Aa 值。在步骤26中,这个平均值可以认为是一定值。 26.对于双标记细胞株的单个细胞来说,要计算以前提到过的某几个 FRET 值 |