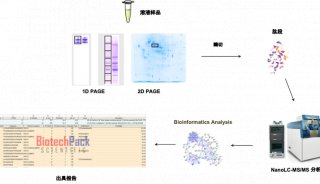
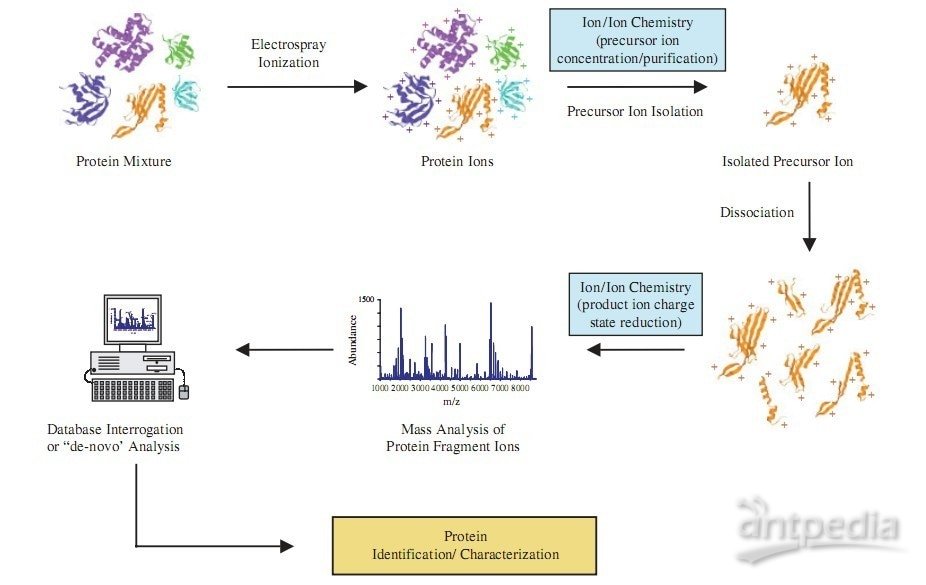
方案5 利用 Nano-LC 耦联 MS/MS 分析复杂蛋白质混合物实验
| 实验材料 | |
|---|---|
| 试剂、试剂盒 | |
| 仪器、耗材 | 酒精灯二元泵或四元泵C18反相层析填料C18固相抽提移液吸头陶瓷划片熔融石英毛细管金线有刻度的玻璃毛细管带压力计的氦气罐高效液相色谱系统激光拉针器Nano-LC 离子源PEEK 微型四通不诱钢增压瓶串联质谱仪 |
| 实验步骤 | 一、纳升级液相色谱柱的制备1.在溶融石英毛细管(大约长 12~15in,即 0.3~0.38m,100um x 365um)的中间部位除去聚酰亚胺涂层。操作如下:将毛细管放在酒精灯的火焰上烤至聚酰亚胺表层烧焦 (见图 8.37),用蘸有甲醇的棉纸擦拭毛细管以除去烧焦的物质(见图 8.38)。 和酒精灯不同,本生灯的火焰太热,可致使毛细管内侧封堵,因此不适用。 2.将除去涂层的毛细管部位放人 P-2000 激光拉针器,拉制毛细管针 (图 8.39)。除去涂层的部位应放进拉针器的反射凹槽内,使激光在凹槽内聚焦,从而熔化硅化的毛细管。 拉针器镜子每个边的臂上都有凹槽和小钳,用以固定硅化的毛细管。表 8.11 列出了拉针器的一些参数,适用于将 100umX365um 的毛细管拉成尖端为约 3um 的喷针。 3.利用不锈钢增压瓶将 C18 反相层析填料装人拉好的毛细管针尖中。
(1)将大约 5 mg C18 反相填料放入一个 1.7 ml 的微型离心管中,然后加入约 Iml 甲醇。 晃动离心管使颗粒悬浮,然后将其放入增压瓶中。拧紧 5 个螺栓,确保增压瓶完全密封。 拧紧 5 个螺栓至为重要。增压瓶盖和增压瓶上都有与O形圈相配的凹槽,关紧增压瓶盖即可达到密封的效果。
(2)增压瓶盖上有一个接头卡套装置,其上有 Teflon 塑料密封套。将硅化的毛细管向下穿过塑料套圈直至其末端,到达微型离心管底部。拧紧塑料套圈,固定毛细管。图 8.40 所示为增压瓶和准备填充反相介质的微型毛细管。 (3)打开氦气瓶向增压瓶施加压力,调节压力计至约 400~800psi(2.76~5.52MPa),然后打开增压瓶上的阀门,向瓶内增压。 此时,填料介质开始填充针状毛细管,直至毛细管微型层析柱制备完毕。为了达到较好的层析分离效果,柱床应填充到 10?15 cm。 4.通过 Up church PEEK 微型四通阀,将针状毛细管连接到 HPLC 上。Up church 微型四通阀的连接布局参见图 8.41。 (1)四通阀的第一个连接点应连接来自 HPLC 泵的传输线。传输线由一根 50um X 365um 的熔融石英毛细管组成,长度应足以从 HPLC 泵到达质谱仪。 (2)第二个连接点与一根用作分流线的熔融石英毛细管连接。分流线将大量液流分流出去,从而降低通过毛细管微型层析柱的流速。这部分毛细管的尺寸和长度取决于来自泵的流速及微型层析柱的长度。最初可尝试使用 100um X 365um 的两叉出口的接头做分流线(请参照步骤⑥)。 (3)第三个连接点连接的是一段金线,通过该段金线将把施加在针状毛细管的溶剂的电压从0提高到 1800V,从而使电喷雾得以进行。 (4)第四个点连接的为已填充好的毛细管微型层析柱。 5.在加样前需要先平衡层析柱,即用 100% 的溶剂 A 置换甲醇,以 150ul/min 流速持续 5 min。 6.5 min 后,用带刻度的玻璃毛细管检测毛细管微型层析柱尖端的液流速度。尖端的理想流速应为约 100~300nl/min。如果流速超过这个值,用陶瓷划片切掉一段分流线毛细管,从而使更多的液体通过分流线流出,如此使较少的液体流过微型层析柱。如果流速低于 100 nl/min,则应使用更长的或更小内径的毛细管,以使更多的液体流过微型层析柱。 检测流速并调节分流线的操作可能会重复多次,直至达到理想流速。 二、样品的浓缩肽段样品可溶解在多种试剂中,其中包括 Tris、碳酸氢铵盐、乙酸、甲酸和尿素。然而,一般来说肽段样品是蛋白质或蛋白质混合物的酶解产物,其中可能会存在一些干扰反相层析和质谱测定性能的试剂(见后述步骤11 的实验提示)。 肽段样品体积可从几微升到 1 ml 或更多。微型层析柱的柱床体积大约为 1.54, 最多可允许 50ul 的样品直接加到层析柱上。若样品体积超过 50 沁,就必须浓缩样品 (详见步骤7~11)。 7.按照下面的操作程序,将 1 ml 甲醇润湿 SPEC Plus PT C18 固相抽提移液器头,推出最多一半的甲醇经过固定相盘面,等待 15~30s,以使盘面活化;再将剩下的甲醇推过盘面,整个过程都不能有空气进入移液吸头的 C18 固相层。 8.用 1ml 溶剂 A 推过盘面以平衡移液吸头。 9.将肽段溶液吸入移液吸头,再推回去。 这一步骤可重复 2~3 次。肽段会存留在移液吸头的 C18 固相层上,从而得到浓缩。弃去流穿液。 10.吸入约 100ul 的 90% 乙腈/0.5% 甲酸,洗脱肽段。将洗脱液推过 C18 固相层,再通过 C18 固相层吸回溶液,然后再推出,从而使洗脱液三次通过 C18 固相层。 11.用真空干燥器除去乙腈,直至肽段完全干燥。将肽段重悬在 10~15ul 的 5% 乙腈/5% 甲酸中。经此处理后,样品即可加到微型毛细管反相层析柱上。
一旦去垢剂进入层析柱,它将与反相填料结合,并在梯度洗脱时同样被洗脱下来,干扰后面的分析过程。去垢剂比肽段更易离子化,因而会掩盖肽段离子。如果肽段样品中包含尿素、甘油或蔗糖等试剂,则会因溶液很黏而给上样带来一些困难。这种情况下一旦上样,则应在梯度洗脱之前,用 100% 溶剂 A 充分淋洗层析柱以除去这些化学物质。 三、将样品加到 C18 层析柱上12.将样品 14000r/min 离心 IOmin, 使所有固相物质沉淀。 13.如果有沉淀,将上清(肽段样品)转移到另一个离心管中。即使是很微量的固体物质也会堵塞层析柱,应予注意。将装有肽段的离心管放入增压瓶,拧紧瓶盖 (拧紧压力瓶盖的操作,参见步骤③a.)。 14.将反相毛细管微型层析柱穿过 Teflon 塑料套圈,直至到达离心管的底部。拧紧塑料套圈,以固定微型毛细管层析柱。 15.将气罐上的压力计设置到 400~800psi(2.76~5.52MPa),然后打开增压瓶上与气罐相连的阀门向增压瓶施压。肽段样品开始流入层析柱。 16.用带刻度的玻璃毛细管检测针状毛细管尖端的上样量。 17.当上样量达到 8~10ul 时,释放压力,然后把层析柱从增压瓶中取出,重新接回到 Upchurch 四通阀上。 四、离子源装置18.将连接好的 Upchurch 四通放到一个平台上,该平台是专门为 ThermofinniganLCQ 系列质谱仪设计的,具有三个功能: (1)放置微型四通,并使之固定在正确位置; (2)当微型四通带有高电压时,可使四通与周围环境绝缘; (3)通过 XYZ 操纵仪,可调整微型层析柱相对于质谱仪人口(加热的毛细管)的位置。 图 8.42 所示的平台包括有机玻璃支持板、微型四通、高电压接头、微型层析柱和质谱仪入口。塑料板上带有 Teflon 塑料螺丝,用来固定各种连接。 位于有机玻璃支持板上的铝质接线柱连有绝缘电缆,可向四通和微型层析柱的溶液施加 1800V 的高压。塑料板可向下压紧,使金线压到铝质接线柱上,使得只有微型四通接有电源,而 XYZ 操纵仪或金属支持物不被接电。 19.使用 XYZ 操纵仪调整微型层析柱的位置,使得毛细管针尖与质谱仪的加热毛细管相距 2~5 mm,电压设为 1.5~1.8kV。 五、HPLC 程序
六、串联质谱分析
|