PEA邻位延伸分析技术的进化史 洞见蛋白组质组学未来
从中心法则洞见蛋白组质组学发展未来
上世纪60年代末,分子生物学中心法则(Genetic Central Dogma)首次从分子水平揭示生命遗传信息的传递奥秘。这一黄金中心法则“DNA转录生成RNA,RNA翻译产生蛋白质,蛋白质反过来协助前两项流程,并协助DNA完成自我复制”在近60年生命科学发展的过程中不断得以验证及阐述。
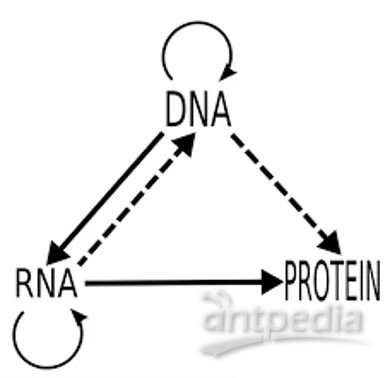
图1: 分子生物学中心法则
人类基因组数据显示,人类大约有2万个基因,是生命奥秘的一级密码。近几年, NGS基因测序和qPCR技术已长足进步,可高通量、多通道地对DNA进行快速鉴定和准确定量,灵敏度及特异性可达特定基因单拷贝。随着20世纪初人类基因组图谱完成,基因组学、转录组学、蛋白组学及多组学技术平台也日新月异,生命科学和现代医学伴随着转化医学快速发展已步入精准医疗/个性化医疗时代[1]。
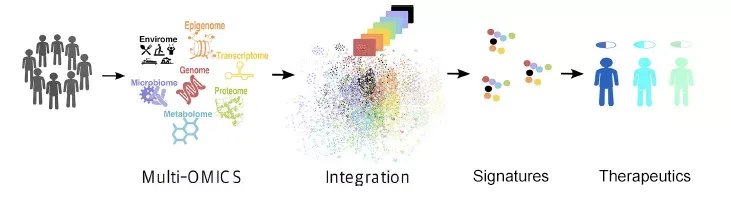
根据中心法则,从DNA到RNA再到蛋白质,这一过经历了转录调控、翻译修饰和蛋白互作等复杂的生物学过程,信息量也将上升1-2个数量级。蛋白质作处于中心法则下游,且是生命活动的最终执行者,其在生命及疾病发生/发展过程中的意义不言而喻,因此,如同人类基因图谱的重大意义,后基因组时代对人类蛋白质组的系统性研究势在必行[2]。

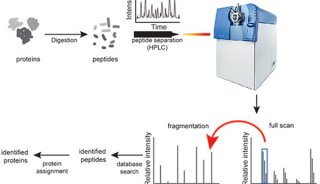
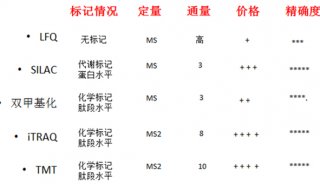
但是,目前蛋白质组学研究远落后于中心法则上游基因组学,一方面是源于蛋白质本身的复杂性,另一方面是受限于现有的蛋白质学技术平台。目前常用的蛋白组学方法,包括双向凝胶电泳、蛋白/抗体芯片和生物质谱等。上述方法都受限于检测速度、通量、多重检测能力、灵敏度等关键因素,使其不能对复杂而庞大人类蛋白组获取充分而有效的信息。传统的蛋白质组学技术中,生物质谱是最常用的方法,可对未知和已知蛋白进行鉴定及定量。但对于低丰度的蛋白,质谱法仍有局限性;此外,蛋白质谱检测需要较长的时间,数据分析也对专业性有很大依赖。以上,都成为了蛋白质组学发展的限速因素。
PEA邻位延伸分析技术的进化史
是否有一种蛋白组学技术,既有基因组学的高通量,又保留了蛋白/抗体识别的特异性,同时克服低丰度检测的局限性?蛋白组学技术新秀—邻位延伸分析技术(Proximity Extension Assay, PEA)给这个问题带来了一个满分答案,也是人类蛋白组学研究这场技术革命的颠覆者。
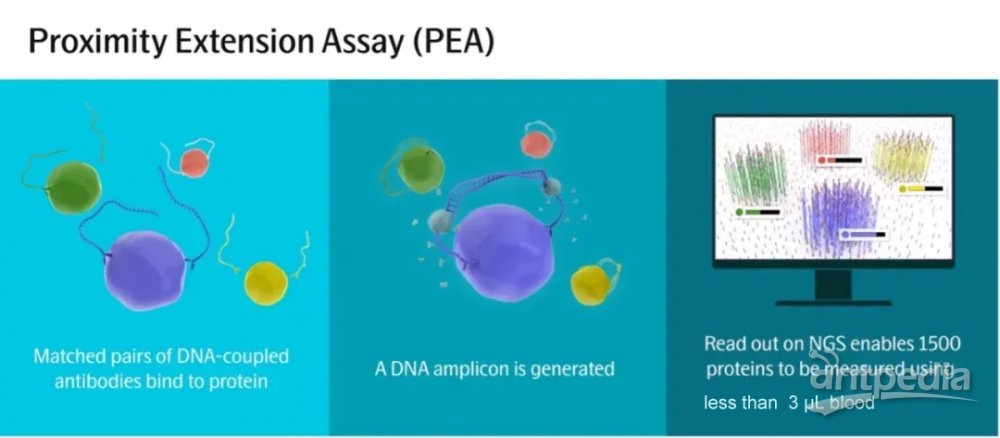
PEA技术是一种高通量、高特异性、高灵敏度、高动态范围的靶向蛋白质组定量检测平台,结合了抗体免疫分析的高特异性和基因组学的高灵敏度/高通量。PEA技术中包含一对可识别目标蛋白的特异性抗体,抗体上偶联有特定的DNA单链,当这对抗体结合目标蛋白后,处于邻位的两条DNA单链可互补结合并经链接酶延伸形成双链DNA模板,巧妙地将蛋白质定量转换为DNA定量,最后利用微流控qPCR或NGS测序进行定量检测。
PEA原理视频
说起PEA技术,其实他已有近20年的成长进化史,是瑞典Uppsala大学分子医学Ulf Landegren教授团队在2002年发明的一项新技术,最早的名字为邻位连接分析技术(Proximity Ligation Assay, PLA)[4]。2004年,Ulf Landegren教授团队,通过不断对PLA技术进行优化,用一对特异性抗体替代最早的DNA-Aptamer核酸适配体,该均相免疫学检测可在1微升样品中检测出fmol 级目标蛋白,比传统ELISA方法灵敏度提高3个数量级,且可进行高通量、超多重检测[5]。

图5: Ulf Landegren教授 [3]
2008年,多家实验室和医院联合,在医学杂志《Clinical Chemistry》发表文章,首次将PLA技术用于血浆样品多重生物标志物检测;且与固相方法相比,PLA方法具有更好的一致性、灵敏度和可扩展性[6]。2011年,Olink Bioscience(Olink Proteomics 前身)研发团队对PLA技术进一步优化,采用在复杂样品中酶活性更高且更稳定的DNA聚合酶代替原来的DNA连接酶,PLA邻位连接分析技术升级为PEA 邻位延伸分析技术,可进一步提高检出率和灵敏度[7]。
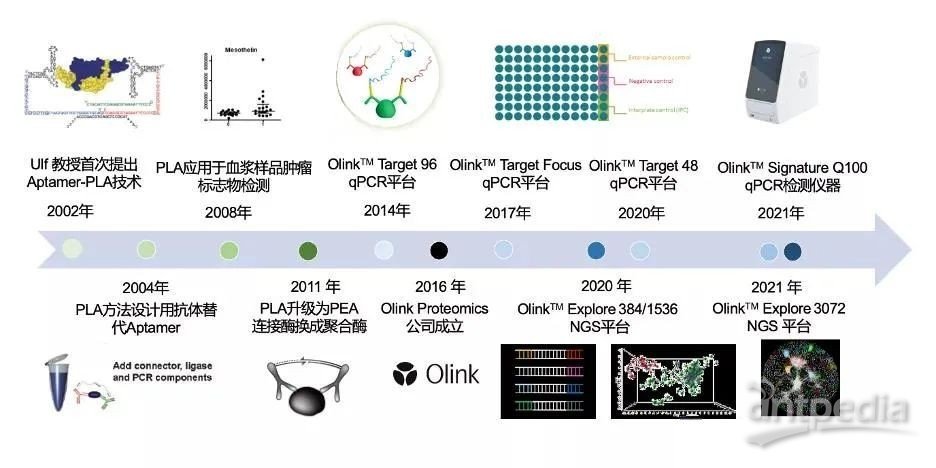
2014年Olink Bioscience研发团队联合丹麦Copenhagen大学健康和医学研究院,开发出基于qPCR检测的96-plex PEA平台,可一次性实现96重蛋白标志物定量检测[8]。2016年Olink Proteomics公司正式成立,致力于为人类健康提供创新且有效的蛋白生物标志物发现及检测方法。在2017和2020年,PEA OlinkTM Focus 订制化平台和OlinkTM Target 48重检测平台分别发布,以更适应Mid-plex生物标志物检测市场需求。2021年下半年,Olink推出专为Target 96/48/Focus全新设计的Signature Q100检测仪器。

在NGS测序技术基础上,Olink公司于2020年推出 Explore 384/1536 平台,可同时检测384或1536中蛋白生物标志物。2021年5月钟雯博士(第一作者)在《Nature Communication》杂志上,运用Explore 1536平台研究二型糖尿病患者在二甲双胍治疗前/后血浆蛋白组改变,发现4个蛋白标志物在治疗前/后显著差异表达[9]。2021年下半年,Olink又在全球范围内发布Explore 3072平台,可从不到8微升样品中检测超过3000种蛋白标志物,并覆盖100%主要生物学通路;这意味着,血浆蛋白组检测实现了生物学意义上的「无偏」,具有划时代的意义。
参考文献:
1. Integrating Genes Affecting Coronary Artery Disease in Functional Networks by Multi-OMICs Approach. Front. Cardiovasc. Med., 17 July 2018.
2. Proteomics Complexity: https://ib.bioninja.com.au/standard-level/topic-2-molecular-biology/24-proteins/proteome.html
3. Ulf Landegren Bio: https://www.vibconferences.be/speaker/ulf-landegren
4. Fredriksson S et.al. Protein detection using proximity-dependent DNA ligation assays. (2002) Nature biotechnology 20:473-477.
5. Gullberg M et.al. Cytokine detection by antibody-based proximity ligation. (2004) PNAS. 101:8420-8424.
6. Fredriksson S. et.al. Multiplexed proximity ligation assays to profile putative plasma biomarkers relevant to pancreatic and ovarian cancer. (2008) Clinical chemistry 54:582-589.
7. Lundberg M. et.al. Homogeneous antibody-based proximity extension assays provide sensitive and specific detection of low-abundant proteins in human blood. (2011) Nucleic acids research 39:e102
8. Assarsson E. et.al. Homogenous 96-plex PEA immunoassay exhibiting high sensitivity, specificity, and excellent scalability. (2014) PloS one 9:e95192
9. Zhong W. et.al. Next generation plasma proteome profiling to monitor health and disease.(2021)Nat Commun. 12(1):2493.