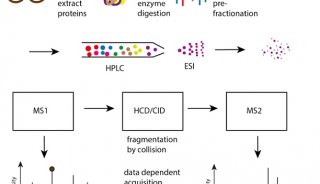
植物蛋白质组学和糖基化实验
实验材料
| 试剂、试剂盒 | |
|---|---|
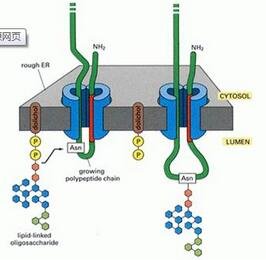
| 实验步骤 | 3.1 这个蛋白质是糖蛋白吗 只有一种方法能全面的回答“这个蛋白质是糖蛋白吗?”这个问题。这需要使用能检测并定量印记上糖蛋白的总糖检测试剂盒。Roche Applied Science 公司商业出品----DIG 聚糖检测试剂盒(产品包含使用说明)提供了这些测定所需的试剂。需要指出的是,在使用这个试剂盒时,蛋白质至少结合有一个糖苷部分才能获得实验结果,这些检测无法提供参与糖基化的寡聚糖分子的类型和其与蛋白骨架连接的相关信息。 3.2 蛋白质是怎样被糖基化的 有几种方法可以用来进行糖蛋白上糖苷特性的鉴定,一种方法包括应用糖蛋白寡糖部分的特异性探针的 Western印迹实验,这种探针有凝集素型和抗体型两种类型。这个方法既不需要进行糖蛋白样品的纯化,也不需要糖苷的解离或分离(见 25. 3. 2 节 1.1)。另一种方法是分离糖蛋白,直接分析与糖蛋白连接的糖苷的单糖组成(见 25. 3.2 节 2.1)。还有一种方法是经化学或酶学处理,将纯化获得的糖蛋白上的糖苷选 择性解离下来。接着通过电泳或质谱对去糖基化之前或之后的糖蛋白进行分析(见 25. 3. 2 节 2.1)。选择性裂解会为我们带来与糖蛋白连接的糖苷的特性。与此同时,通过质谱鉴定到的蛋白分子质量的差异将为我们提供与糖蛋白连接的糖苷的结构信息。 1. Western 印迹检测糖苷的方法 一维或二维电泳胶的 Western 印迹可用来检测糖蛋白上糖苷。用于这种检测的探针大多具有 N- 连糖苷特异性。 1 ) 凝集素亲和检测 凝集素是一类可与寡聚糖部分特异结合的植物蛋白质,它们已被鉴定出具有对哺乳动物糖蛋白的亲和性,这些凝集素列于表25-1 中,其中只有一少部分可用于植物糖蛋白的检测(见注释 2) 。 这类凝集素商品是凝集素-生物素化形式。通过链霉亲和素-辣根过氧化物酶标识物,辨别凝集素和寡糖。但是,唯有刀豆球蛋白 A 例外,因为它可直接结合到过氧化物酶上。下面是这两种方案的具体内容: 凝集素- 生物素/链霉亲和素-过氧化物酶方法: ( 1 ) 通过 1D 或 2D 电泳分离,并转移到硝酸纤维素膜上。 ( 2 ) 用 TTBS 缓冲液浸泡印迹膜 1 h ( 见注释 3) 。 ( 3 ) 将印迹膜在含有凝集素-生物素复合物(0.1 mg/20 ml) 的 TTBS 缓冲液中,室温下浸泡 2 h。 ( 4 ) 在 TTBS 缓冲液中漂洗 4 次,每次 15 min。 ( 5 ) 将印迹膜在以 1:1000 稀释在 TTBS 缓冲液中的链霉亲和素-辣根过氧化物酶标物中,室温下温育 1 h。 ( 6 ) 在 TTBS 缓冲液中漂洗印迹膜 4 次(每次 15 min) ,显影前在 TBS 溶液中漂洗一次。 ( 7 ) 在一个烧杯中将 30 mg 4-氯-1- 萘酚溶解在 10 ml 冷甲醇中(一20℃),在另一个烧杯中的 50 ml TBS 缓冲液中加入 30 μl H2O2。在要显影印迹膜时,合并上面这两个烧杯中的溶液,配制成过氧化物酶显影混合液(要现用现配),轻轻摇动来优化显影反应。 ( 8 ) 倒掉显影混合液,并用蒸馏水漂洗印迹膜数遍,终止显影反应。晾干印迹膜,夹在两层滤纸之间保存。 ( 9 ) 实验对照,请见注释 4 。 刀豆球蛋白 A (ConA)- 过氧化物酶方法(根据参考文献 20 修改的方法)。 ( 1 ) 通过 1D 或 2D 电泳分离,并转移到硝酸纤维素膜上。 ( 2 ) 用 TTBS 缓冲液浸泡印迹膜 1 h。 ( 3 ) 将印迹膜在含有 ConA ( 25 μg/ml)的 TTBS 缓冲液中,室温下温育 2 h。 ( 4 ) 在 TTBS 缓冲液中漂洗 4 次,每次 15 min。 ( 5 ) 将膜放置在含辣根过氧化物酶(HRP,50 μg/mL) 的 TTBS 缓冲液中,室温下温育 1 h。 ( 6 ) 在 TTBS 缓冲液中漂洗印迹膜 4 次(每次 15 min),显影前在 TBS 溶液中漂洗一次。 ( 7 ) 过氧化物酶的显影作用与凝集素-生物素/链霉亲和素-辣根过氧化物酶方法中的相同。 ( 8 ) 实验必须设对照,见注释 4。 2 ) 特异性抗体的免疫检测方法 我们已经报道了植物 N-复合糖苷的 β-1-2 木糖和 α-1-3-岩藻糖抗原表位在兔子血清中具有高免疫 [21] 。因此,含复合糖苷的糖蛋白抗血清往往含有抗 β-1-2 戊醛糖和 α-1-3 海藻糖的抗体。一些商业免疫血清与我们自制的探针具有相同的特性。如抗 HRP 的免疫血清可用作植物含有 α-1-3 岩藻糖和 β-1-2 木糖残基的复合 N-糖苷的特异性探针。从蜂毒蛋白中获得的免疫血清具有更强的特异性,可用作含 α-1-3 岩藻糖的植物复合糖苷的特异性探针[ 21] 。我们在实验室,从兔血清中获得了对复合型糖苷末端天线(三糖 Lewisa ) 的特异性兔抗体 [22] 。抗 Lewis a 的单克隆抗体已商业化,但其非常昂贵。  阿拉伯半乳糖蛋白(AGP ) 和伸展蛋白可用商业单克隆抗体检测(http://W W W . plantprobes.co.uk/) 。我们实验室没有使用过这些抗体,请参考描述这些抗体特异性的原始论文(见注释 5) 。 ( 1 ) 通过 1D 或 2D 电泳分离,并转移到硝酸纤维素膜上。 ( 2 ) 用 含 3% 明胶的 TBS 缓冲液,室温下浸泡印迹膜 1 h。 ( 3 ) 用 含 1% 明胶和适宜稀释浓度的免疫血清的 TBS 缓冲液,室温下浸泡印迹膜 2 h。我们使用的 25. 2.2 节 1.2 ) 中提到的商业免疫血清,稀释方法如下: a. 兔抗 HRP 免疫血清,1 : 300。 b. 兔抗蜂毒蛋白免疫血清,1 : 200。 c. 鼠抗 Lewis 单克隆抗体,1 : 100。 ( 4 ) 在 TTBS 缓冲液中漂洗 4 次,每次 15 min。 ( 5 ) 用 含 1% 明胶和适当的标记抗体的 TBS 缓冲液,室温下浸泡印迹膜 1 h。标记抗体可为 1 : 2000 稀释的 HRP 标记羊抗兔 IgG (G 型免疫球蛋白)抗体,或 1 : 500 稀释的 HRP 标记羊抗鼠多价免疫球蛋白抗体。 ( 6 ) 在 TTBS 缓冲液中漂洗印迹膜 4 次(每次 15 min) ,显影前在 TBS 溶液中漂洗—次。 ( 7 ) 过氧化物酶的显影作用与凝集素-生物素/辣根过氧化物酶方法中的相同( 见 25.3.2 节 1.1)。 ( 8 ) 对照见注释 6 和注释 7。 2. 糖苷单糖组分的分析 糖苷单糖组分的分析是通过用甲醇-HCl 溶液水解糖蛋白,然后用气相色谱鉴定和分析单糖产物及其衍生物。单糖组分分析结果提供了连接到糖蛋白和/或 N-连寡聚糖)上的糖苷类型的初步数据。 ( 1 ) 将 1 mg 纯化的蛋白质样品放入带聚四氟乙烯涂层的螺旋盖子的玻璃管中,进行冻干处理(见注释 8) 。 ( 2 ) 向待测蛋白质样品中加入 5~10 μl 的 2 mmol/L 肌醇贮藏液(见注释 9) 。甲醇分解反应之前再次冻干处理样品。 ( 3 ) 在蛋白样品中加入 500 μl 浓度为 1 mol/L 甲醇-HCl 溶液,旋紧盖子,置于 80°C 加热过夜。 ( 4 ) 甲醇分解反应后的样品在氮气保护下,40°C 加热干燥处理样品。注意:因甲醇有毒,应在通风橱中操作。 ( 5 ) 用 250 μl 甲醇漂洗,如步骤(4 ) 的操作,在氮气环境下干燥处理样品,重复漂洗步骤两次。 ( 6 ) 用 250 μl 甲醇重悬样品,接着加入 25 μl 的乙酸,25 μl 吡啶,匀浆,在室温下放置 6 h,如步骤(4 ) 的操作,在氮气环境下干燥处理样品。 ( 7 ) 加入 250 μl 的硅烷化试剂,80°C 温育 20 min ( 见注释1) ,空气吹干样品。 ( 8 ) 用 1 ml 环己烷冲洗,空气吹干,并重悬于 200 μl 环己烷中,匀浆,离心,将 100 μl 衍生物样品转移到带盖的反应小瓶中。 ( 9 ) 设置气相色谱仪的氦气压强设为 1.4 bar,注入样品前要将注射器和 FID 检测器分别加热到 250°C 和 280°C 。设置氦气的压力为 20 psi,流速为 3 ml/min。在注入 5 μl 的衍生物样品(相当于 25 μg 蛋白质)之前,平衡色谱柱的温度到 120°C。温度梯度洗脱单糖衍生物:① 每分钟升高 10~160°C。② 每分钟升高 1.5~235°C。③ 235°C 4 min。 ④ 每分钟升高 20~280°C。⑤ 280°C 3 min。 3. 糖基释放后的蛋白质分析 1 ) 糖基释放的化学处理方法 还原性氨化反可应选择性的解离糖蛋白上的 O-糖苷(见注释 10) 。去糖基化的蛋白用 1D SDS-PAGE 分析,将其迁移情况与其糖基化形式的蛋白进行比较,电泳迁移率的增加是 O-连糖苷出现在蛋白上的证据(见注释 11)。 ( 1 ) 将 1 mg 纯化的蛋白样品放入带聚四氟乙烯涂层的螺旋盖子的玻璃管中,进行冻干处理。 ( 2 ) 将干燥样品溶解于 500 μl 硼氢化钠溶液中,盖紧玻璃管,37°C 过夜放置。 ( 3 ) 逐滴添加乙酸来终止还原性氨化反应,直至无气体产生。再加入 500 μl 的 10% 乙酸甲醇溶液。在通风橱内风干。重复洗涤过程 3 次以洗去剩余的硼酸盐。 ( 4 ) 去糖基化处理后,去糖基化蛋白用 4 倍体积的乙醇于 -20°C 过夜沉淀处理,用合适的缓冲液溶解沉淀物用于 1D SDS-PAGE。同时可回收乙醇相中的糖苷,用于单糖组分分析(见 25. 3.2 节 2) 。 2) N-或 O-糖苷酶的酶促处理 用糖苷酶处理纯化获得的糖蛋白可得到进一步的信息。内切糖苷酶 H ( Endo H ) 只能通过水解 N-糖苷中心的两个 GlcNAc 残基之间的糖苷键,来解离植物糖蛋白中的高甘露糖型的 N-糖苷(图 25-3)。多肽 N-糖苷酶( PNGase) 通过水解位于肽链骨架天冬酰胺和寡聚糖近端 GlcNAc 之间的键,解离高甘露糖 N-糖苷和复合 N-糖苷。PNGaseF,一种被广泛应用于哺乳动物糖蛋白分析的 N-糖苷酶,可解离高甘露糖 N- 糖苷和复合 N-糖苷,但不能水解与邻近 GlcNAc 连接的 α-1-3-岩藻糖残基。PNGaseA 可解离所有类型的植物糖苷(图 25-3),但它几乎只对糖肽起作用,所以需要在去糖基化之前酶解糖蛋白 [23,24] 。糖蛋白或肽的去糖基化分析方法有:①电泳迁移的增加;② Endo H 或 PNGaseF 处理后,糖蛋白对糖苷特异性探针免疫活性的丧失;③ EndoH、 PNGase F 或 PNGase A 处理后的质谱分析。对于 O-糖苷酶可以采用同样的手段和方法,但是我们实验室很少用,因此不在此详述(详情见参考文献 25 和 26)。 内切糖苷酶 H 去糖基化。 ( 1 ) 在用 EndoH 去糖基化酶促处理之前,将纯化获得的蛋白质在 1% SDS ( m/V)存在下,100°C 加热变性处理 5 min。  ( 2 ) 用 150 mmol/L 乙酸钠溶液(pH 5.7 ) 将样品稀释 5 倍,加入 10 mU 的 Endo H,将混合液在 37°C 温育 6 h。 ( 3 ) 如果酶切后要进行电泳、亲和反应或者免疫检测,那么,要在去糖基化反应后,加入等体积的两倍浓度的电泳样品缓冲液(见 25.3. 2 节 1) ,酶切处理后的样品也可脱盐处理,用于质谱分析。 肽 N-糖苷酶 F去糖基化: ( 1 ) 用 含 0.1% SDS 的 0.1 mmol/L Tris-HCl ( pH 7.5 ) 消化处理待酶切的蛋白样品。 ( 2 ) 样品在 100℃ 加热 5 min,将蛋白质变性。室温下降温,然后加入含 0.5% Nonidet P-40 的等体积的 0.1 mmol/L Tris- HCl,pH 7.5 ( 见注释 12)。 ( 3 ) 用肽 N-糖苷酶 F 37°C 温育样品 24 h ( 1 U 酶/100 μg 蛋白用)。 ( 4 ) 酶解消化后,用 4 倍体积的乙醇在 -20°C,过夜沉淀去糖基化蛋白质。 ( 5 ) 离心样品。回收沉淀中的去糖基化蛋白,并将其溶解在适当的缓冲液中,供凝胶电泳和质谱分析。 肽 N-糖苷酶 A 去糖基化: ( 1 ) 将 100 μg 蛋白质样品溶解在 500 μl 的 10 mmol/L HCl ( pH 2.2 ) 中,加入 10 μg 胃蛋白酶,37°C 消化 24 h,再次加入同样量的胃蛋白酶,继续消化 24h。100°C 加热 5 min 终止反应。 ( 2 ) 冷却样品,然后取 10% 的溶液用 C18 色谱柱纯化肽和糖肽混合物。 ( 3 ) 用 5 mL 乙腈冲洗 C18 层析柱,再用 5 mL 水冲洗 C18 层析柱。用蒸馏水将稀释的样品定容至终容积为 1 ml,加样到 C18 层析柱。用 5 mL 水冲洗柱子去除样品中的盐分,用 5 ml 乙腈洗脱结合到柱子上的肽。吹干乙腈浓缩肽样品。用 MALDI-TOF 质谱检测肽和糖肽的分子质量,这样可在内切糖苷酶 A 处理之前,获得糖肽的质量数据。 ( 4 ) 将剩余的样品冷冻干燥,溶解在 500 μl 的 100 mmol/L 乙酸钠溶液(pH 5.5 ) 中。 ( 5 ) 将样品用 0.1 mU 肽 N-糖苷酶 A 在 37°C 消化 18 h。然后冷冻干燥样 品,用 C18 色谱柱,按照步骤(2 ) 和 步骤(3 ) 的操作,将肽与寡聚糖分开。通过 MALDI-TOF 质谱分析去糖基化肽,比较去糖基化处理前后得到的两种谱型,得到一些由于 N- 糖苷的去除引起的离子质量差异,结合去糖基化过程中所使用的酶和植物糖蛋白的信息,来判断蛋白质上 N-糖苷的种类和结构形式。 这个实验所需要的试剂都包含在检测试剂盒中,商品酶促去糖基化试剂盒由 Prozyme 公司生产。需要说明的是,按厂家说明使用该试剂盒。实验者可以获得有关被测糖蛋白上的糖苷类型(N - 和 O- 连接)的信息。 3.3 我的糖基化蛋白在哪 实验人员可通过这个方法获得关于糖苷在蛋白骨架上的分布及糖苷本身的结构信息。这类实验可在纯化的糖蛋白或者从 1D 或 2D 电泳胶上分离出来的蛋白上进行,首先,用蛋白内切酶消化蛋白质,通过高效液相色谱(HPLC) 分离消化后的肽和糖肽混合物。对含有糖苷的收集组分进行糖组分分析(见 25.3.2 节 2 ) ,接着分别对肽 N-糖苷酶 A 处理前后的糖肽组分进行 MALDI- TOF 质谱分析 [ 见 25.3.2 节 3)] 。 ( 1 ) 将 1 mg 纯化得到的蛋白质样品溶解在 500 μl 的 50 mmol/L 碳 酸氢铵溶液(pH 8.0 ) 中,100°C 加热 3 min。 ( 2 ) 加入 50 μg TPCK 处理胰酶,在 37°C 处理 2 h。 ( 3 ) 再次加入 50 μg TPCK 处理胰酶,37°C 处理 2 h。 ( 4 ) 如果进行双酶切处理,用 50 mmol/L 碳酸氢铵溶液(pH 8.0 ) 溶解 50 μg TPCK 处理糜蛋白酶,将其加到胰蛋白酶消化液中。37°C 处理 2h。 ( 5 ) 100°C 加热 5 min 终止蛋白酶消化反应。 ( 6 ) 用反向 HPLC 色谱(C18 色谱柱)分离胰蛋白酶/糜蛋白酶消化得到的肽和糖肽,使用 0~60% B 溶液的 60 min 线性梯度洗脱,流速为 1 ml/min,214 nm 紫外监测洗脱峰。A 溶液:含 0.1% TFA (三氟乙酸)的水/乙腈 (90 : 10 ) 溶液。B 溶液:含 0.1% TFA 的水/乙腈(10 : 90 )溶液。收集各组分容积为 2 ml,冷冻干燥收集到的 组分。 ( 7 ) 各取 10% 的收集组分进行糖组分分析(见 25. 3.2 节 2 ) ,挑选含寡聚糖的组分。 ( 8 ) 用 MALDI-TOF 质谱分析含糖肽的 HPLC 组分确定糖肽的质量。 ( 9 ) 用肽 N-糖苷酶 A 消化糖肽 [ 见 25. 3. 2 节 3. 2)]。如前所述用 C18 色谱柱将肽 和寡聚糖分开 [ 见 25.3.2 节 3. 2)]。 ( 10 ) 用 MALDI- TOF 质谱分析去糖基化肽,确定其质量。这些质量数据帮助实验人员鉴定被测蛋白质的糖基化位点。检测到的糖基化和去糖基化肽的质量差异将为我们提供糖蛋白上糖苷的结构信息( 表 25-2)。 本实验方法也可以应用于未知序列的蛋白质。在这种情况下,用 LC-MS/MS ( 液相串联质谱)分析、确定糖基化肽的氨基酸序列。解离下来的糖苷也可以采用前述的特定流程的 MALDI-TOF 质谱纯化和鉴定 [18,19] 。 3.4 怎样对全糖蛋白质组进行分析 植物提取物内糖蛋白的鉴定可确定以下几点:① 哪些基因编码糖蛋白。② 潜在糖基化位点上的哪些位点确实发生了糖基化。③ 糖蛋白上的糖苷的特性与结构是什么。这些研究过程现被称为糖蛋白质组学。在动物细胞中已经实现了这些鉴定实验,但在植物糖蛋白质组鉴定方面还未见报道。 我们实验室最近开发的研究植物糖蛋白质组的策略依赖于固定化凝集素的纯化,1D 或 2D 电泳的分离,以及质谱鉴定。糖蛋白质组的分离有以下两种方法:含高甘露糖型 N-糖苷的分泌糖蛋白的纯化和 O-GlcNAc 糖基化修饰的糖蛋白的纯化。这里只着重介绍糖蛋白的选择方法,不具体介绍电泳和质谱鉴定。有关这些技术的详细信息请参见本书其他章节。 1. 含高甘露糖型 N-糖苷糖蛋白的鉴定 本方法是我们实验室以油菜籽为实验材料建立的,本方法也适用于其他植物材料。  ( 1 ) 将 6 g 植物材料放入 4°C 预冷的研钵中,加入 50 ml 预冷的 TBS 缓冲液,研磨萃取蛋白质(见注释 13),接着 10000 g 离心萃取物 30 min,去掉不溶物,然后 150000 g 离心 1 h,沉淀膜碎片。用 Bradford 蛋白检测方法测定上清液中的可溶性蛋白浓度。将样品分装成每份含 20 mg 蛋白质,冷冻存备用。 ( 2 ) 4°C 解冻一份 20 mg 的样品,10000 g 离心 30 min,0.20 μm 过滤膜过滤去除所有的不溶物。加入冷 TBS 缓冲液定容至 35 ml,加入 CaCl2 和 MgCl2 至终浓度为 1 mmol/L。 ( 3 ) 将相当于 1 ml 刀豆蛋白 A-琼脂糖树脂重悬在 50 ml TBS 缓冲液中,用 50 ml 的 TBS 缓冲液冲洗树脂 2 次 ,每次冲洗后通过沉降或者离心(3500 g,10 min) 回收树脂。 ( 4 ) 洗漆后的树脂与 35 ml 样品于 4°C,在旋转振荡器上振荡 2 h。将树脂倒入 PolyPrep 柱子中,冲洗去除未结合在柱子上的蛋白质。 ( 5 ) 先用 50 ml TBS 缓冲液冲洗树脂 5 次,再用 50 ml TBS 缓冲液冲洗树脂 5 次,然后如步骤(3 ) 所述方法,用 50 ml TBS 缓冲液重悬树脂。 ( 6 ) 将树脂倒入 Poly- Prep 柱子中,去除残余的 TBS 缓冲液,用 10 ml 含 0.3 mol/L α-甲基甘露糖 TBS 缓冲液重悬柱子中的树脂。置于 4°C 旋转振荡 1 h ( 见注释 14)。 ( 7 ) 用 15 倍体积的含 0.3 mol/L α-甲基甘露糖的 TBS 缓冲液洗脱糖蛋白,用同样的溶液冲洗树脂,混合这两部分样品,最终的混合物就是纯化的连接高甘露糖型 N-糖苷的糖蛋白。 ( 8 ) 用 Bradford 蛋白检测方法确定蛋白浓度,在 12.5% 三氯乙酸(最终浓度)中,4°C 过夜沉淀糖蛋白样品。10000 g 离心 15 min 沉淀蛋白,用丙酮/水 [ 9 : 1 ( V/V )] 溶液冲洗沉淀,再次离心。重复洗涤过程两次,将蛋白质溶解在适当的样品缓冲液中供 2D 电泳分析用。 ( 9 ) 用 2D 凝胶分离糖蛋白,蛋白点通过胶态蓝染色。分别收集每个可视的点(见注释 15)。胰蛋白酶酶解收集到的蛋白点。用 LC-MS/MS 分析酶消化产物。提交获得的肽段序列信息到 NCBI 非冗余数据库在可选择的物种限制范围内,进行 “短的、几乎准确的匹配” blast 检索(http://www. ncbi. nlm. nih. gov/BLAST/)。 一经鉴定,糖蛋白应进行以下两点鉴别:① 它们是被分泌出来的,或其有一个潜在的信号肽吗?② 它们至少拥有一个潜在的 N-糖基化位点吗?一个蛋白质中的糖基化位点可通过与 Prosite 数据库(http : //npsa- pbil. ibcp . fr /cgibin / npsa _ autom at, p i ? page = npsa _ prosite , html 或 http:// www . expasy . org /tools /scanprosite / ) 比对确定。 2. O-位 N-乙酰葡糖胺糖基化蛋白的鉴定 鉴定 O-GlcNAc 糖蛋白质组需要麦胚凝集素(WGA) 亲和层析的糖蛋白纯化。之前的实验表明 WGA 既可以结合 O-GlcNAc 糖蛋白也可以结合带 N-糖苷的蛋白质[ 28] 。所以必须预先去除 N-糖苷,才能用亲和层析柱选择性地纯化 O 位 N-乙酰葡糖胺糖基化蛋白。这个去糖基化过程可通过能去除高甘露糖型和复合型 N-糖苷的肽 N-糖苷酶 F 来实现。但是如前所述,由于与邻近 N-糖苷中心 GlcNAc 连接的 α-1-3 岩藻糖的存在,肽 N-糖苷酶 F 对植物复合型糖苷的作用很有限 [ 见 25. 3. 2 节 3. 2 ]。为了克服这个不利因素,要让植物材料保持对 PNGaseF 敏感的高甘露糖型糖苷形式。本实验方法是我们实验室开发的用于将突变体的细胞培养物的 N-糖苷转变为 Man5GlcNAc2 结构 [29] 。这个实验方法应该适用于其他的植物材料,实现高甘露糖型 N-糖苷的糖基化。 ( 1 ) 用神奇滤布过滤 150 ml 细胞培养物,然后将细胞培养物悬浮在 150 ml 0.5 mol/L NaCl 溶液中,4°C 搅拌 30 min 溶解以离子键结合细胞壁上的蛋白质(见注释 16 和注释 17)。 ( 2 ) 用神奇滤布再次过滤细胞培养物。弃上清,在含 150 mmol/L KCl、2 mmol/L CaCl2、10 mmol/L MgCl2、1 mmol/L DTT 和蛋白酶抑制剂的 30 ml 20 mmol/L Tris-HCl,pH 7.8 ( WGA 缓冲液)中研磨细胞培养物。 ( 3 ) 4°C 下萃取物经 5500 g 离心 15 min,接着 25000 g 离心 30 min 后,弃去不溶物,分装到 5 ml 管中。 ( 4 ) 用 Centricon 离心超滤管(Amicon Bioseparation YM-10 ) 将 5 ml 的组分浓缩到 0.5 ml。 ( 5 ) 浓缩后,加 SDS 到样品中使其含有 0.1% SDS,100°C 加热 5 min 变性处理糖蛋白。再加入 NonidetP40 使其终浓度为 0.5% ( 见注释 12)。蛋白质处理变性后,加入 PNGaseF ( 5 U ),37°C 搅动温育 24 h 进行蛋白质去糖基化反应。这一步骤中,只有 N-糖苷被消除掉。 ( 6 ) 用 WGA 缓冲液将去糖基化样品稀释 20 倍,将其与 100 μl WGA-琼脂糖混合,4°C 旋转振荡 4 h。用柱体积 20 倍的 WGA 缓冲液冲洗树脂去除未结合在柱子上的蛋白质。 ( 7 ) 为了洗脱结合在柱子上的蛋白质,将树脂与 5~10 倍体积的含 0.5 mol/L GlcNAc 的 WGA 缓冲液在 4°C 混 合 30 min ( 见注释 18)。收集洗脱液, 重复相同的洗脱处理一次。合并这两次洗脱液,这个糖蛋白组分只含有 O-位 N-乙酰葡糖胺糖基化蛋白质。 ( 8 ) 加入三氯乙酸达到终浓度为 12.5%,4°C 过夜沉淀糖蛋白。10000 g 离心 15 min 沉淀蛋白质,用丙酮/水 [ 9 : 1 ( V/V ) ] 溶液洗涤蛋白沉淀 3 次,将蛋白质沉淀物悬浮在一种适当的缓冲液中供 1D 电泳备用。 ( 9 ) 用 1D SDS-PAGE 凝胶电泳分离 O-位 N-乙酰葡糖胺糖基化蛋白质。经考马斯亮蓝染色后,收集胶内的所有可见条带,经胰蛋白酶消化后,用 MALDI-TOF 或 LCMS/MS 鉴定蛋白质。 3.5 结论与展望 应用本章所列的实验方法可获得一个植物糖蛋白的糖苷及其组成单元、连接方式的功能。事实上,相同的寡糖序列连接到不同的糖蛋白上,或出现在植物体内不同的位置,亦或出现在植物生活周期的不同时间,都可能表现出不同的功能。因此,新兴的糖蛋白质组学研究正,为了解 N-糖苷和 O-糖苷的作用,开劈一条新的途径。缩短这一领域的差距将拓展我们对于植物生理学的认识,也为生物化学和医学提供了更加广阔的前景。 |
推荐
热点排行
一周推荐