单细胞蛋白质组学:让细胞个体研究更加精细
细胞是生命活动的基本单元。对细胞的精确认知是理解细胞在生理和病理过程中功能的先决条件。
在组织、器官或个体中,细胞具有非常大的异质性,而传统的研究手段针对大量细胞进行分析,得到的是大量细胞的平均结果,无法区分不同细胞个体对于大量样品结果的具体贡献值,从而忽视或掩盖了单细胞的个体差异,不能完全捕捉细胞的复杂性、多样性以及功能的不同。
因此非常有必要开发新技术在单细胞水平揭示细胞异质性,目前对单细胞技术的需求越来越高。
PART01 实现单个细胞蛋白质组成的定性定量分析,揭示细胞个体之间的精细差异
二代测序技术的持续发展使对单细胞基因组和转录组的研究突飞猛进,科学家们对细胞认识的分辨率大大提高,然而单细胞的基因组和转录组数据对描述细胞在生物体复杂环境中的表型和功能还远远不够,而蛋白质作为细胞内所有功能的直接执行者,细胞通过蛋白质及其翻译后修饰,可以感知并响应几乎所有外在和内在的刺激,从而影响整个生命体的功能和状态。
因此,对单细胞蛋白质组的定性和定量分析,是揭示细胞类型及其状态的必不可少工具,在肿瘤异质性、干细胞分化、生殖细胞发育、循环肿瘤细胞等重要领域有着不可或缺的应用价值。
单细胞蛋白质组学的目的就是为了实现对单个细胞内蛋白质组成的定性和定量分析,从而获得不同细胞个体蛋白组的定性和定量差异,构建精细蛋白分子图谱,从根本上揭示不同细胞个体之间的类型及其状态的差异,使科研工作者可以更好地了解细胞及其表型和生命活动。
PART02 挑战单细胞蛋白质组学研究的难点和瓶颈
单细胞蛋白质组学技术的难点和瓶颈主要在于单细胞内极其微量的蛋白质,一般单个细胞内的蛋白质总量仅不到200 pg,而其又是由上万种不同种类的蛋白质组成,这些蛋白质以极高的动态范围、不同的拷贝数存在于一个单独的细胞中。
直接对这些蛋白质进行组学鉴定分析,在其样品前处理、分离和质谱检测都是一种挑战。因此受到极微量样本制备、超高灵敏度高分辨生物质谱仪等限制,单细胞蛋白质组学分析一直都是“圣杯”一样存在。
PART03 百花齐放,各有所长
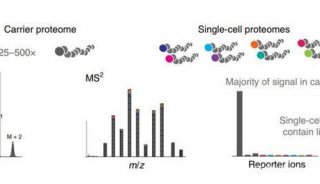
目前为解决单细胞极微量样本制备的难点,科学家们开发出来一种体系是基于TMT进行标记的方法,如scope2。
Scope2研究系统主要是通过TMT的多通道优势,将其中一个通道作为carrier cell通道,一般为20~200个细胞量的样品,其他通道作为单细胞通道。各通道在完成TMT标记后进行混合上机检测。
采用carrier cell通道的优点有如下几点,第一、可以有效补偿单细胞样品在后续分析中的损失;第二、其对蛋白质的定性可以使用含量更高的carrier cell通道中的MS/MS,而借助TMT各通道报告离子进行定量;第三、大大提高单细胞检测的通量。

基于scope2技术的单细胞蛋白质组学分析流程 https://doi: 10.1186/s13059-021-02267-5
除此之外,还有研究者采用基于液滴的样品前处理系统,如nanoPOTS、gOAD、nested nanoPOTS(N2) chip和proteoCHIP系统,这类系统主要优点有:1)液滴体积小可以减少与管壁接触转移带来的样品损失问题;2)小体积液滴与单细胞样品兼容性更好,具有更高的酶切反应速率。但也有其不足之处,比如该液滴操作系统需要在具备相关操作能力的实验室开展,还需开发适用于液滴体系上样的新技术。

基于液滴体系的样品前处理和离心处理上样系统proteoCHIP的工作流程https://doi.org/10.1101/2021.04.14.439828
其中在N2 chip和proteoCHIP系统中结合了微流控液滴和TMT标记的技术,可进一步提高单细胞分析的检测通量和定量蛋白质数目。
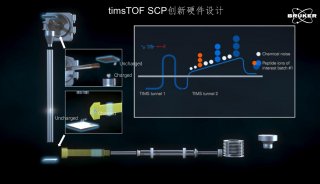
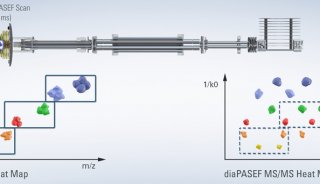
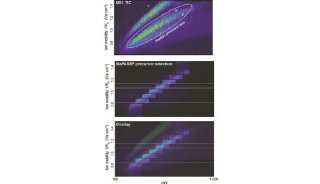
此外,还有一类是结合超高灵敏度质谱仪timsTOF和DIA采集模式,在前处理过程中缩小反应体系到2ul左右以此减少样品损失,实现单细胞的蛋白质组学分析。

基于液滴体系的样品前处理和液滴自动进样器的N2系统工作流程https://doi.org/10.1101/2021.02.17.431689
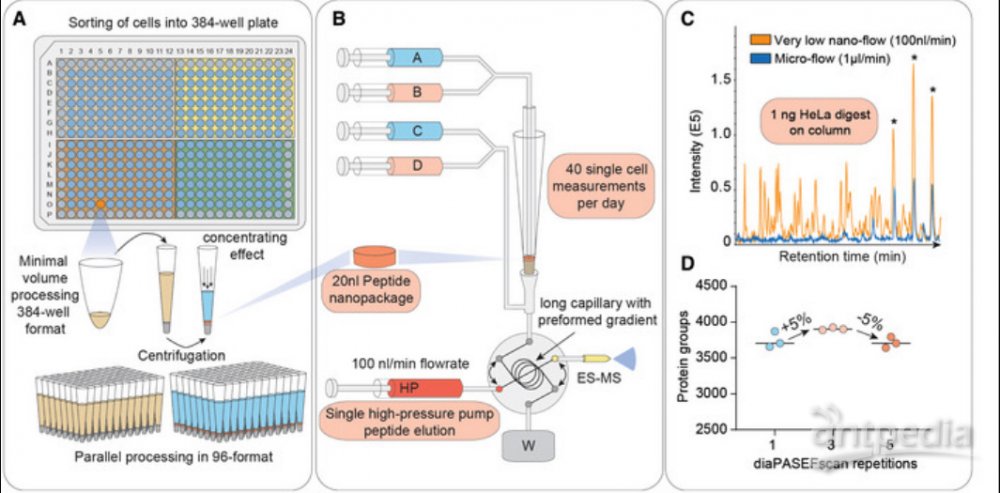
基于Evosep和timsTOF-DIA联用的单细胞样品前处理系统https://doi.org/10.1101/2020.12.22.423933
PART04 精准医学应用领域突破创新性进展
通过单细胞蛋白质组学分析可以根据差异蛋白质信息来区分不同肿瘤细胞的分子分型,相较于传统的病理组织分析技术更加精细准确,对于理解疾病的发生发展具有重要的意义。
另外,一些生物学样品由于稀少,单细胞技术是唯一可以对其进行研究的技术。例如在胚胎发育早期阶段少量个数的细胞、在神经生物学领域越来越得到重视的单个神经元以及数量稀少的循环肿瘤细胞等,传统蛋白组学技术无法获得这类样品的蛋白质组学数据,因此单细胞蛋白质组将是必要的手段,对于组织亚结构研究、胚胎发育、肿瘤异质性、CTC细胞、干细胞分化和神经研究提供重要的生物学意义。
基于质谱的单细胞蛋白质组研究进展
蛋白质是生命活动生理功能的执行者,它更直观的表现生命的活动现象,它直接参与机体的免疫应答、免疫调节和催化过程。
蛋白的表达的差异的水平会更直观的反应机体的生理状况和发病机制,蛋白质的定量检测对疾病的诊断、预后评价有着重要的意义。
我们通常研究的蛋白质组更多的是通过基因组、转录组的信息对蛋白信息进行预测,从中心法则DNA到mRNA再到蛋白,由于转录水平调控、翻译后水平调控、翻译后调控的存在使得DNA的遗传信息和mRNA水平丰度不能真实的直接反映蛋白质的功能和表达水平。
传统组织上的蛋白定量更多的是反应细胞中蛋白表达的平均值,由于遗传因素、生化噪音、细胞微环境等诸多因素使得细胞和细胞之间存在广泛的异质性。
如果能从单个细胞反映生命活动的直接体现者,不仅对生命的本质有更深的认识,而且会为疾病的诊疗提供强有力的支持。
相对与对基因表达分析,测定单个细胞中的蛋白是个更大的挑战,单细胞的蛋白含量非常低,平均每个细胞中约包含8*109个蛋白质分子(700pg),但却含有一万多种蛋白质,某些种类的蛋白质分子甚至小于100个。蛋白的表达量的测定无法直接像DNA、RNA那样直接扩增。
在2020年发表在顶级期刊的MCP(Mol Cell Proteomics)的综述(single-cell proteomics: progress and prospects):单细胞蛋白质组学进展与展望中文章从也对样品制备、到质谱仪、方法学的难点进行详细讨论。

当然基于不同的原理、针对不同的应用场景近些年来也涌现了很多单细胞蛋白质定量的的检测方法,比如微流控技术、微孔技术、光纤纳米生物传感技术、荧光探针技术和基于质谱的单细胞蛋白检测技术。
如微流体技术Health课题组通过单细胞条码芯片( single-cell barcode chip,SCBC) 的方法来进行单细胞蛋白检测,对单个肿瘤的细胞蛋白质进行了多重分析。
Huang等也利用微流控技术在一张芯片上完成细胞的处理、裂解、标记、分离和蛋白定量检测过程,Salehi-Reyhani等基于微流控抗体芯片实现单细胞中P53肿瘤抑制蛋白丰度检测,该方法更多的用于蛋白和蛋白间的会做及磷酸化的作用的研究。

以Health 课题组微流控举例(如上图)
a)单细胞、细胞内蛋白质分析装置的示意图。
将单个或少数细胞置于不同刺激下的隔离室中培养。通过引入预先引用的裂解缓冲液来检测细胞内的蛋白质,释放的蛋白质在腔内结合到DNA条形码上。
V1:裂解缓冲液控制阀,V2:隔离室形成阀,R1: DNA条形码阵列转换成DEAL抗体阵列
b) c)已开发的条形码检测的对比增强图像。用红色字体列出的蛋白质名称与使用条形码检测的蛋白质名相称对应
d) b单细胞裂解液具有代表性的荧光强度分布图
微流控技术本身更依赖于装置的设置,装置的设置决定于单细胞蛋白检测的通量,一般情况下检测10-1000个不等的蛋白,具有很高效益和灵敏度,但是自制的微流控很难保证一个微室保证一个单细胞。
微孔技术对于单细胞蛋白的检测方法包括数字化酶联免疫吸附测定法、单细胞蛋白印迹法、基于DNA的纳米免疫测定法,它们主要的缺点和微流控一样,不同的微孔中存在差异,难以保证一个微孔正好捕获一个细胞。
而质谱的方法其灵敏度较高,通过已有的蛋白质组学数据库,同时可以对上万种蛋白同时进行定量。我们重点和大家分享基于质谱的单细胞蛋白质组的研究方法。
质谱的单细胞蛋白质组主要需要解决样本的复杂性和提高单细胞的灵敏度,质谱前处理和分离技术的选择对此发挥着至关重要的作用,根据质谱分析前分离技术的差异,主要从毛细管电泳-质谱(CE-MS)、液相色谱-质谱(LC-MS)进行简要介绍。
1.单细胞蛋白质组之毛细管电泳-质谱(CE-MS)
早在2014年,Sun等通过电驱动鞘液型接口将毛细管区带电泳与串联质谱结合,实现300ngHela细胞的蛋白酶解液中鉴定2100种蛋白,最低的检测限可以低至 2 amol。
除了在Hela细胞进行测试,Nemes课题组首次较大的单细胞进行内源的蛋白质分析-16-细胞非洲爪蟾早期胚胎的囊胚细胞。
首先通过显微解剖的方法从胚胎中分离单细胞,然后裂解、还原、烷基化,最后通过毛细管电泳-升电喷雾-高分辨质谱(CE-μESI-HRMS)从直径约150μm的20ng单个囊胚细胞鉴定1630种蛋白。
除了通过显微解剖的方法还可以通过微采样的方法,微采样的方法消耗样本量少,流程简化,排除显微方法使用基质使得单细胞的蛋白鉴定更准确。
比如Lom-bard-Banek等对胚胎进行亚细胞区域采样,提取物在压力的作用下转移至微量移液管中进行胰蛋白酶解,最后实现进样10nL酶解液,利用利用毛细管电泳-纳升电喷雾-高分辨质谱分析,最低低于700z mol的检出下限,在5ng蛋白酶解液中鉴定不少于800个蛋白。尽管蛋白的量和检测下限逐渐减少,但样本的复杂度依旧很高。
Choi等通过CE前加入用于预分离的反相C18柱,对单细胞水平的老鼠海马体神经元蛋白酶解物进行分析,最后从500pg的蛋白酶解物鉴定141个蛋白。
这一灵敏度近乎达到了单细胞的水平,但是样本的复杂度还不是单个细胞的水平;为了近乎接近单个细胞的水平,利用毛细管的微小管径实现单细胞内容物的转移。
如Zhang等通过利用管径10μm的毛细管对田螺特定的神经元细胞质和细胞核取样,利用离子淌度质谱(IMMS)发现了新的神经肽,揭示了神经元细胞内区域表达的异质性。
通常CE-MS的研究应用更多集中在大体积的细胞上,实验流程基本和常规蛋白质的提取和鉴定方法一致。
利用比单细胞更小的毛细管管径对亚细胞区域进行提取和鉴定是毛细胞管电泳的一大特色,也是离传统意义单细胞最接近的技术手段。
毛细管电泳-质谱需要面临仍然有很多问题:CE与质谱接口的稳定性、重复性、电泳吸附时面临损耗,未来单细胞之路实现简单、容易操作的标准化还是需要不断更新和探索。
2.单细胞蛋白质组之基于液相色谱的分离
对于毛细管电泳来说,液相色谱中的纳升液相色谱(nanoLC)其重现性、nL级别的进样、超低的流速(nL/min)、较少的样品损失等特点在单细胞蛋白质组学的应用范围更广。
Sun等利用纳升液相色谱的反相分离模式研究了非洲爪蟾早期胚胎的囊胚细胞,单次实验从16细胞分裂阶段的细胞中鉴定1400多个蛋白,通过比较不同阶段蛋白质的表达情况,证实了随着分化程度的不断加深,囊胚细胞间的异质性逐渐增强。
Slavov课题组发展一种基于LC分离的单细胞蛋白质定性以及相对定量方法-单细胞蛋白组学质谱(SCoPE-MS)。
该方法首先在显微镜下将单个Hela细胞挑选至玻璃管中,经过超声破碎、过夜酶解等蛋白质前处理步骤,利用TMT标记技术对不同细胞间的蛋白质进行相对定量,整个过程中引入载体“carriers”概念,利用单独的TMT通道进行标记,在于待测细胞混合后同时检测,载体的存在减少了单细胞表面依附造成的损失,为质谱离子化提足够的多肽,增加后续肽段的鉴定。
这一概念为单细胞技术的发展提供了重要参考。为了解决通量的技术,后续改进在纯水中冷热交替实现细胞裂解,引入微孔板进行细胞样品处理从而提高通量。
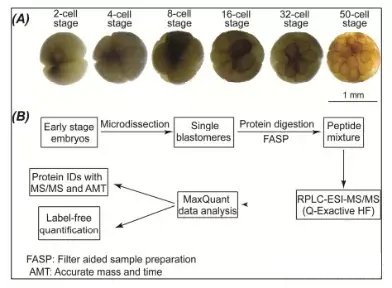
Sun等利用纳升液相色谱的反相分离模式研究了非洲爪蟾早期胚胎的囊胚细胞
A)爪蟾胚胎显微照片。B)从胚胎分离的单个卵裂球单细胞蛋白质组学的工作流程
2018年Nature Communications在线发表“Nanodroplet processing platform for deep and quantitative proteome profiling of 10-100 mammalian cells”的研究论文,是由美国华盛顿州国家环境分子科学实验室的Ryan T. Kelly团队最新研究成果。
基于质谱(MS)的蛋白质组学方法大部分需要包含至少数千个细胞的样本来提供深入的分析,课题采用了基于芯片的纳升级微量液滴蛋白处理系统nanoPOTS。
该平台nanoPOTS (nanodroplet processing in one pot for trace samples) 可以基于小细胞群体进行蛋白质组学的分析,nanoPOTS可将处理量降低至200nL以下,减少表面损失,提高了样品的效率和回收率;与超灵敏的液相色谱质谱联用仪相结合时,nanoPOTS可以从10-140个细胞中鉴定到约1500-3000个蛋白。
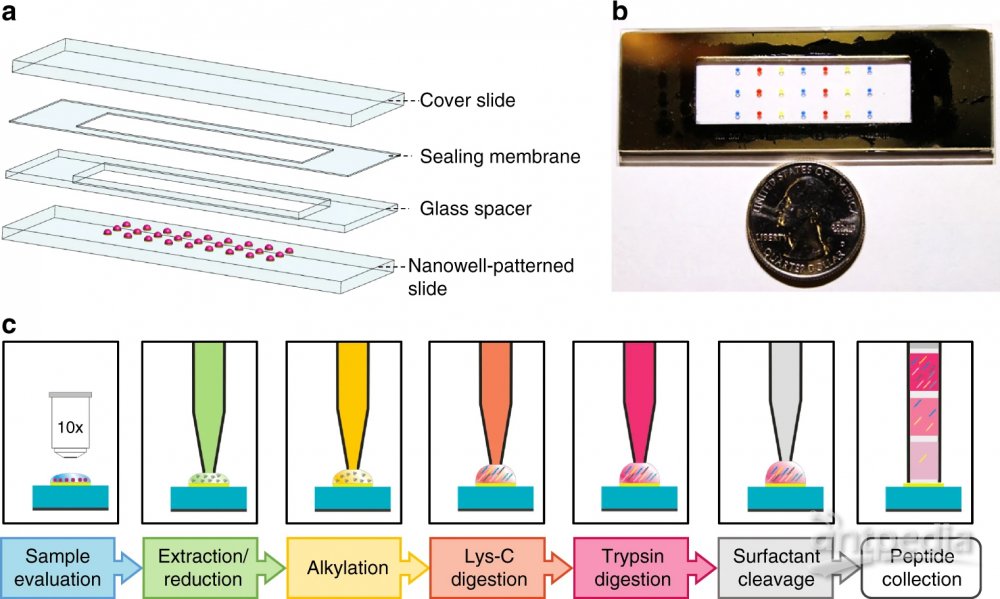
NanoPOTS平台蛋白质组学的样品制备
NanoPOTS玻璃芯片是用光刻方式制作的亲水底座,周围环绕着疏水表面,作为多步蛋白质组学样品处理的纳米液滴反应容器(纳米井)。
芯片玻璃垫片密封在镀膜的载玻片上,以在各个培养步骤中最大限度地减少纳米孔内容物的蒸发。
通过芯片的纳升级微量液滴蛋白处理系统nanoPOTS,对细胞和组织沉积到每个腔室中
在腔室中完成样品的定量、蛋白的提取、烷基化和酶解等过程,最后保存冰箱中或转移至LC-MS进行后续分析。

nanoPOTS平台的灵敏性和蛋白质组覆盖度
1)利用NanoPOTS系统对HeLa细胞的敏感性和的蛋白质组覆盖率进行测试。
作者分别对10-14 、37-45 和137-141个Hela细胞进行测试,蛋白质的肽段鉴定范围在7364-17836。
蛋白质的鉴定范围在1517-3056个。
3)通过Maxquant的MBR的定性分析发现当最小到最大的上样量时,平均蛋白的识别率增加到3092、3215和3460,并且85%的蛋白是全部样品所共有的,进一步说明较少的样品中可以鉴定和定量到更多蛋白质。
基于液相色谱的单细胞处理体积逐渐降至nL级别,将一系列蛋白质在样品处理步骤整合在微小的体积中,通过设置密封条件、减少洗涤步骤等方式来降低样品的损失,进而结合nanoLC-MS进行分离和检测。
对于细胞裂解过程、蛋白前处理是否高效、是否对肽段标记等步骤仍然等是影响单细胞蛋白鉴定数目和种类的重要因素
无论是采用哪种原理实现标准化、应用广泛的单个细胞的蛋白质组仍有很多困难要克服,随着单细胞蛋白质组检测的灵敏度、蛋白覆盖度、细胞通量、空间分辨率等技术的优化,相信单细胞蛋白质组学在解决基础科研和临床转化问题的应用会更加广泛。
前沿综述 | 单细胞-蛋白组分析技术及其应用
以蛋白质组为目标的单细胞分析技术有哪些?它们有哪些应用?
来自加拿大的研究团队在《Nature reviews chemistry 》发表了单细胞蛋白组技术相关的综述,回顾了单细胞蛋白组分析技术,并评估其优势和局限性。所介绍的新兴技术有可能揭示对肿瘤异质性和治疗耐药性的新见解,阐明免疫反应和免疫疗法的机制,并加速药物的发现。

单细胞蛋白组分析工具
目前还没有在单细胞水平上进行全蛋白组分析的工具可供商业使用,但已经开发了几种技术用于高复用蛋白分析。最广泛使用的方法有:基因编码荧光蛋白与高分辨率成像相结合;基于抗体的策略与流式细胞术或微流控技术相结合;以及质谱技术。

用于蛋白分析的荧光探针
GFP是一种基因编码的报告基因,由于荧光蛋白具有良好的生物相容性,在大量的单细胞蛋白质分析研究中,人们利用基因转染技术将荧光蛋白与目的蛋白连接起来。毛细管电泳(CE)是一种很有前途的单细胞分析细胞质蛋白的工具。在荧光团的光转化过程之后检测荧光的远场成像方法,例如光激活定位显微镜,揭示了RAS的二聚依赖性信号机制。
但实现荧光蛋白融合文库的分析方法受到读出次数的限制,读出次数受可用荧光团的光谱重叠的限制,并且如果荧光蛋白和宿主蛋白之间的连接体不够长且不稳定,则可能发生对天然蛋白功能的潜在阻碍。此外,这些蛋白对于应用样本也有限制,其跟踪时间不能超过它们的光漂白点,这限制了它们在长时间尺度实验中的应用。
基于抗体的蛋白分析
基于抗体的单细胞蛋白检测可以与显微镜、流式细胞术或微流控平台相结合,生成高通量的数据集。1)显微技术,如免疫细胞化学和免疫组织化学,是最简单的单细胞蛋白质检测,可以提供单细胞分辨率的蛋白质定位的空间信息;2)流式细胞术,荧光激活细胞分选(FACS)是最成熟的蛋白分析方法,其通常用于分析和分类活细胞,对于分离特定的细胞表型以进行后续的下游分析非常有用。流式细胞术的一个主要缺点是在制备过程中细胞间失去接触。此外,细胞受到机械剪切力的作用,这种剪切力可改变细胞内的信号传递行为;3)通过飞行时间进行细胞计数,飞行时间质谱流式细胞术(Cytometry by time of flight,CyTOF)是分析细胞表面和细胞质蛋白的最先进技术之一,其还可用于分析固定组织,从而为免疫组化分析提供了一个强有力的选择。这项技术还可以与免疫细胞化学和免疫组织化学方法相结合,以亚细胞分辨率同时成像多达32种蛋白和蛋白质修饰。CyTOF还可以促进高维单细胞CRISPR筛选。然而,CyTOF不能对活细胞进行分类。其他缺点包括商业金属同位素标记抗体的有限可用性以及与大数据集的质量控制和分析相关的挑战。由于回收率不是100%,因此CyTOF也很难用于小细胞集的单细胞水平检测。4)微流控平台,基于微流控技术的单细胞蛋白质测量工具包括液滴微流控技术、微刻方法、单细胞条形码芯片(SCBCs)、单细胞Western印迹和磁排细胞仪(MagRC)。这个领域非常活跃,正在产生许多新的系统。
质谱技术
质谱在蛋白质组学中取得成功的根本原因在于其固有的特异性和理论上延伸到单一离子的高灵敏度。尽管目前的质谱分析方法在灵敏度和细胞通量方面受到限制,但使用液滴微流体将样品体积从微升减少到纳升无疑可以提高其分析性能。目前,质谱法普遍用于蛋白分析。
单细胞的蛋白组+转录组分析
将蛋白组学和转录组学分析整合到单一的多组学方法中提供了在单个细胞中检测RNA表达和蛋白质丰度的动力学可能性,这反过来可能产生对复杂调控过程的机制性见解,例如表观基因组、转录和转录后基因监管。此外,同步的mRNA和蛋白质分析可用于确定mRNA和蛋白质水平在活跃的转录后调控期间相关性较差的细胞状态。
最直接的分析蛋白质水平和RNA表达的方法是使用单个细胞的索引FAC同时测量同一细胞中的少量蛋白质和相应转录物的水平。另一种方法依赖于邻近延伸分析(PEA)与RNA分析并行进行蛋白检测。
邻近连接分析(PLA)依赖于两个抗体结合的寡核苷酸在同一蛋白质靶点上的连接而不是杂交。这种方法被用来研究蛋白质-蛋白质相互作用的亚细胞定位,例如RNA的PLA在mass-cytometry工作流程中实现,以便能够同时定量单个原代人类外周血单个核细胞中的10个转录物和相应蛋白质。
通过测序、RNA表达以及蛋白测序分析对转录组和表位进行细胞索引的两种方法利用与DNA条形码结合的抗体,以便能够在单细胞水平上同时分析细胞表面蛋白质和mRNAs。CyTOF与单细胞RNA测序相结合可以追踪树突状细胞(DC)谱系的发育。
可以想象,将单细胞蛋白组学方法与多组学工具相结合,可以促进我们对细胞过程的理解,特别是对癌症抵抗机制和治疗反应多样性的理解。

单细胞蛋白组学工具的应用
了解肿瘤异质性和治疗耐药性
病理学家早就认识到许多蛋白质在肿瘤细胞中的不均匀表达。例如大多数B细胞恶性肿瘤患者用靶向CD19的嵌合抗原受体T细胞治疗。这些患者最初对治疗有反应,但约30%的患者复发,因为肿瘤细胞表达由选择性剪接产生的CD19亚型,并且缺乏编码抗原表位的外显子。在这些情况下,单细胞蛋白质组学工具可用于全面研究治疗性耐药的机制——无论是预先存在的和/或获得性的——并因此采取更有效的治疗策略。
癌症免疫治疗
单细胞蛋白分析已被用于表征T细胞亚型及其祖细胞,以及它们在不同免疫疗法诱导下对癌症的反应。此外,单细胞蛋白质组学结合T细胞受体链和配对新抗原的DNA测序提高了我们对这种配对的认识,并指导了一些癌症免疫治疗策略。单细胞蛋白分析方法也支持了采用性细胞转移方法的进展。
高通量药物筛选
高通量药物筛选能够全面评估生物活性分子对单个人细胞的影响,可以为临床前开发提供有价值的指标,并最终基于对患者细胞表型的离散性知识指导治疗选择。例如CyTOF可以通过对每个细胞进行条形码编码来评估药物库对具有深维度的单个细胞的影响、每个细胞具有独特的质量特征、报告其位置和每种药物的测试剂量。
随着单细胞蛋白质组学技术的不断发展和成熟,每个细胞可以测量的参数数量和分析的细胞数量都将继续增加。单细胞蛋白组学和相关数据分析的未来发展可能会成为扩大和完善单细胞多组学方法所需的关键基石,使我们能够建立一个全面的人类细胞图谱,包括人体的每一个细胞,以及关键模型生物的配套图谱。虽然目前可用的工具正在为复杂的生物现象提供前所未有的可视化和分辨率,但还是需要下一代的单细胞检测来提供更广泛的蛋白质组覆盖面。
参考文献
Labib, M., Kelley, S.O. Single-cell analysis targeting the proteome. Nat Rev Chem 4, 143–158 (2020). https://doi.org/10.1038/s41570-020-0162-7
图片均来源于参考文献,如有侵权请联系删除。