肝细胞癌药物治疗现状与前景
日本卫材公司与默克公司于当地时间2018年8月16日发布消息称,FDA日前批准了此两家公司联合开发的激酶抑制剂类抗肿瘤药物乐伐替尼(Lenvatinib,商品名Lenvima,药用其甲磺酸盐胶囊剂)用于不可手术摘除的肝细胞癌的一线治疗,从而使乐伐替尼成为FDA近十年来批准的首个用于治疗这一适应证的药物。
肝细胞癌,简称HCC。是最常见的原发性肝癌。根据中华人民共和国卫生部2017年颁布的《原发性肝癌诊疗规范(2017版)》,原发性肝癌是我国目前第4位的常见恶性肿瘤及第3位的肿瘤致死病因,严重威胁我国人民的生命和健康。原发性肝癌主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)和HCC-ICC混合型3种不同的病理类型,三者在发病机制、生物学行为、组织学形态、治疗方法及预后等方面差异较大,其中HCC占到89%~90%。
HBV感染是全球范围内确诊HCC病例的主要病因,其中以亚洲人群最为明显,而HCV、酒精性肝硬化、非酒精性脂肪性肝炎(NASH)则是西方社会人群中HCC的主要病因、虽然HCC在原发性肝癌中占据很大的比例,但在2018年8月以前,获FDA批准用于HCC一线治疗的药物只有索拉非尼(Sorafenib,商品名Nexavar,药用其甲苯磺酸盐的片剂),而且索拉非尼在有效性与安全性方面均存在有诸多不尽如人意之处,因此HCC的预后面临着严峻的挑战。本文对索拉非尼与乐伐替尼在HCC治疗中的应用情况进行了简述,而且介绍了正处于临床试验阶段的代表性HCC药物。
一线治疗
(1)索拉非尼
索拉非尼是拜耳公司开发的一种阻断Raf激酶、血管内皮生长因子受体(VEGFR)与血小板衍生化生长因子受体(PDGFR)的多重酪氨酸激酶抑制剂。FDA于2007年批准索拉非尼用于HCC的一线治疗,作为其批准依据的SHARP临床试验共纳入了602名肝功能有所保留的受试者,并在随机分组后分别采用索拉非尼400mg QD与安慰剂治疗。结果显示,与安慰剂相比,索拉非尼仅能带来中位的生存效益,两者的整体生存时间(OS)中位值分别为10.7个月与7.9个月(索拉非尼vs安慰剂,HR?=?0.69;95%CI 0.55–0.87;p?<?0.001)。索拉非尼的缓解率极低,仅有7名患者(2%)实现部分缓解。据报道,索拉非尼HCV导致的HCC患者的效益高于其对其他病因所致HCC患者的效益。SHARP试验的探索性分析结果显示,HCV所致HCC患者亚组中,索拉非尼的OS中位组约是安慰剂的两倍(14.0个月 vs 7.4个月),相比之下,HBV阳性患者亚组与酒精相关性HCC患者亚组内索拉非尼与安慰剂相比的优势则不那么明显,两个亚组内的OS中位值分别是9.7个月vs 6.1个月与10.3个月vs 8.3个月。索拉非尼会升高腹泻、减重、手-足皮肤反应与低磷血症的发病风险。SHARP试验中的大部分受试者均为Child-Pugh A级患者;对于Child-Pugh B级肝癌患者而言,大部分医师均会调整其给药剂量;但对于Child-Pugh B级肝癌患者而言,则出于安全性考虑而不对其采用索拉非尼治疗。虽然索拉非尼在安全性与有效性上仍然存在有诸多不足,但仍然是近十年内唯一的用于晚期HCC全身治疗的药物,因此迫切需要改善HCC患者的治疗与护理水平。
根据FDA的橙皮书信息,索拉非尼在中国的化合物ZL(CN00802685.8)有效期截至2020年1月,而其甲苯磺酸盐的晶型ZL(CN200580040775.0)的有效期截至2025年9月。
根据拜耳公司的年报信息,2017年索拉非尼的销售额为8.34亿欧元,同比下降4.1%。拜耳公司将索拉非尼销售额的降低归因于需求降低与价格压力增加。此外,Mylan制药已经于2017年针对索拉非尼在美国的ZL提出了ZL挑战,并提出了ANDA申请。
(2)乐伐替尼
乐伐替尼是由卫材公司开发的新型酪氨酸激酶抑制剂,其作用靶点包括VEGFR 1~3、成纤维细胞生长因子受体(FGFR 1~4)、PDGFRα与RET。FDA先于2015年2月批准乐伐替尼用于治疗局部复发性或转移性、进展性、放射性碘难治性的分化型甲状腺癌,而后又于2016年5月批准其与依维莫司联合,用于治疗先前接受过抗血管生成疗法的晚期肾细胞癌患者。
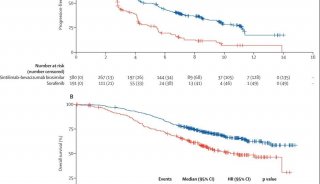
FDA此次批准乐伐替尼扩大适应证的决定,系以REFLECT临床试验(304号研究)的数据为基础,该项临床试验以先前未接受治疗的且不可手术的肝细胞癌患者为对象,结果证实乐伐替尼用药患者的总生存时间(OS)非劣于索拉非尼,而前者的无进展生存时间(PFS)与客观缓解率(ORR)则统计学显着性地优于索拉非尼,从而达到了临床终点。
具体的,REFLECT试验的结果显示,乐伐替尼组与索拉非尼组的OS分别为13.6个月与12.3个月(HR=0.92;95%CI:0.79~1.06),到达了非劣性的临床终点。该项临床试验的次级终点指标结果如下表所示。
REFLECT试验中,乐伐替尼组观察到的最常见的不良反应(≥20%)包括高血压、疲劳、腹泻、食欲降低、掌跖红感觉障碍综合征、蛋白尿、发声障碍、关节痛/肌痛、高血压、体重降低、出血事件、甲状腺功能低下与恶心;最常见的严重不良反应(≥2%)包括肝脑病(5%)、腹水(3%)与食欲降低(2%)。索拉非尼组最常见的不良反应(≥20%)的不良反应包括掌跖红感觉障碍综合征、腹泻、疲劳、高血压、腹痛、食欲降低、皮肤、体重降低与关节痛/肌痛;最常见的不良反应(≥2%)包括腹水(2%)与腹痛(2%)。
另据路透社的消息,卫材公司于当地时间8月18日将乐伐替尼的价格定为1.7万美元/月,而此前的定价为1.36万美元/月(8mg、10mg与14mg)与1.47万美元/月(18mg、20mg与24mg)。路透社还表示,乐伐替尼有望于2022年实现34.6亿美元的销售额。
乐伐替尼在中国已经进入上市申请阶段(JXHS1700042),且被纳入优先审评,有望于获准上市。
乐伐替尼在中国申请的化合物ZL(CN01819710.8)已授权,将于2021年10月届满,但其甲磺酸盐晶型ZL(CN200480036184.1)的有效期截至2024年12月。
(3)其他疗法
数项研究评价了多种其他药物单独用药(如贝伐珠单抗、舒尼替尼与brivanib)或联合索拉非尼(多柔比星、厄洛替尼)在HCC一线治疗中的有效性与安全性,但不幸的是,所有药物对患者生存情况的改善效果均不及索拉非尼单独用药的效果。其中,一项单组Ⅱ期临床试验结果显示,抗VEGF的单克隆抗体贝伐珠单抗以5mg/kg或10mg/kg的剂量每两周给药一次,其客观缓解率(ORR)与无进展生存时间(PFS)分别为13%与6.9个月;一项Ⅲ期、随机化、安慰剂对照的双盲临床试验结果显示,在索拉非尼的基础上添加厄洛替尼治疗,并不能改善HCC患者的生存情况,具体的,厄洛替尼联合索拉非尼与单用索拉非尼的OS中位值分别为9.5个月与8.5个月(HR=0.929;P=0.408);一项纳入了1073名先前未接受过治疗的晚期HCC患者的Ⅲ期临床试验结果表明,舒尼替尼组的生存情况劣于索拉非尼组(7.9个月vs 10.2个月),而且会显着加剧不良反应。化疗在晚期HCC治疗中的效益尚不明了,其中多柔比星是最常用的化疗药物之一,其缓解率在20%左右。然而,Ⅲ期的CALGB却未能证实多柔比星联合索拉非尼的效果优于单用索拉非尼的效果,再者的OS中位值分别为10.5个月与9个月。
二线治疗
(1)靶向治疗
长期以来,索拉非尼是晚期HCC治疗的唯一药物,但一旦患者病情出现进展,或对索拉非尼出现不耐受性,医师则往往拿不出标准的治疗方案。化疗虽然在HCC二线治疗中的作用尚不明了,但仍然是医师不得不尝试的治疗方案之一,这种情况一直到FDA批准瑞戈非尼与纳武单抗用于接受索拉非尼后病情进展的患者的二线疗法时,才有所改观。一项Ⅲ期随机化的CELESTIAL试验证实了Cabozantinib的整体生存效益,REACH-2试验证实了Ramucirumab对伴有甲胎蛋白水平升高的HCC患者的整体生存效益。
① 瑞戈非尼
瑞戈非尼是由拜耳公司开发的一种血管源性VEGF 1~3、瘤原性与基质受体酪氨酸激酶抑制剂,最早于2012年9月获FDA批准用于转移性结肠癌的二线治疗。2017年4月,FDA以Ⅲ期、随机化、双盲与安慰剂对照的RESORCE试验为依据,批准瑞戈非尼用于HCC的二线治疗。RESORCE纳入的患者均对索拉非尼有良好的耐受性(停药前28天采用≥400mg/d的剂量至少治疗20天),而且肝功能均为Child-Pugh A级。共有573名患者接受了随机化分组与治疗,其中,瑞戈非尼组的OS值显着优于安慰剂组(10.6个月vs 7.8个月;HR=0.63;95%CI:0.50~0.79;P<0.0001)。瑞戈非尼组最常见的3级或4级不良反应,包括高血压、手-足皮肤反应、疲劳与腹泻。由于该项研究仅纳入了采用索拉非尼治疗时病情出现进展,而且对索拉非尼的耐受性也有要求,因此,瑞戈非尼用于对索拉非尼不耐受的患者时是否有效尚无定论。此外,该项试验还表明,如果在对不良反应予以有效控制的同时,按顺序采用多激酶抑制剂进行治疗,将有助于延长患者的生存时间。
瑞戈非尼在中国申请的化合物ZLCN200480021091.1已获授权,其有效期截至2024年7月;瑞戈非尼以一水合物供药用,其晶型的中国ZLCN200780037680.2也已获授权,有效期截止2027年9月。
根据拜耳公司的年报信息,2017年瑞戈非尼的销售额为3.15亿美元,同比增长14.5%。由于瑞戈非尼于2017年4月才获准用于HCC的二线治疗,因此其销售额主要由结肠癌与胃肠道间质瘤所贡献。
② Cabozantinib
Cabozantinib是由Exelixis公司开发的一种MET、VEGFR与AXL抑制剂,已获FDA批准的适应证包括甲状腺髓样癌、肾细胞癌。
CELESTIAL试验则以安慰剂为对照,评价了该药对先前接受过治疗的晚期HCC患者的有效性与安全性,而与RESORCE试验不同的是,CELESTIAL并不要求受试者对索拉非尼耐受。共有707名患者接受了随机化分组与治疗,Cabozantinib组与安慰剂组的OS中位值分别为10.2个月与8.0个月(HR=0.76;95%CI:0.63~0.92;P=0.0049),两组的PFS中位值分别为5.2个月与1.9个月(HR=0.44;95%CI:0.36~0.52;P<0.0001),Cabozantinib的这两个指标均显着优于安慰剂组。Cabozantinib vs 安慰剂组最常见的不良反应包括:手-足皮肤反应(17% vs 0%)、高血压(16% vs 2%)、天冬氨酸转氨酶水平上升(12% vs 7%)、疲劳(10% vs 4%)与腹泻(10% vs 2%)。由于其改善OS与PFS的效果显着,Cabozantinib有望获FDA批准用于HCC的二线治疗。
FDA橙皮书中收录的Cabozantinib化合物ZLUS7579473未进入中国;Cabozantinib药用其S-苹果酸盐,但橙皮书中未收录晶型ZL,而包含其S-苹果酸盐的组合物的中国ZL原案申请CN201180044602.1尚在审查阶段。
根据Exelixis的年报信息,2017年Cabozantinib的全球销售额为3.49亿美元,同比增长158%。
③ Ramucirumab
Ramucirumab是一种与VEGFR-2受体结合并阻断后者活化的单克隆抗体。起初一项纳入42名先前未接受过全身治疗的Ⅱ期临床试验中,Ramucirumab的ORR与OS中值分别为10%与12个月,提示该药可产生中度的治疗活性。一项名为REACH的Ⅲ期临床试验比较了Ramucirumab与安慰剂对先前采用过索拉非尼治疗的晚期HCC患者的有效性与安全性,两者的OS中位值分别为9.2个月与7.6个月,Ramucirumab与安慰剂相比并无显着的优势。但随后的亚组分析结果显示,Ramucirumab对确诊时甲胎蛋白>400ng/mL的患者的效益优于安慰剂。随后的REACH-2试验则纳入了292名基线甲胎蛋白升高且采用索拉非尼治疗后病情进展或对索拉非尼不耐受的HCC患者,该试验显示,与安慰剂相比,Ramucirumab可显着改善患者的OS(8.5个月vs 7.3个,P=0.01999)、PFS(2.8个月 vs 1.6个月,P<0.0001)与疾病控制率(59.9% vs 38.9%,P=0.0006)。Ramucirumab组最常见的不良反应包括高血压与低钠血症。
④ 依维莫司
依维莫司是哺乳动物雷帕霉素靶分子(mTOR)抑制剂,mTOR是细胞生长与血管生成重要的调控因素,而这一通路在HCC患者中的表达率为40%~50%。一项以采用索拉非尼治疗后病情进展或对索拉非尼不耐受的HCC患者为对象的大规模Ⅲ期临床试验显示,依维莫司与安慰剂的OS分别为7.6个月与7.3个月。
⑤ 阿西替尼
阿西替尼是一种以VEGFRs为靶点的第二代酪氨酸激酶抑制剂。一项纳入了202名采用索拉非尼治疗后病情进展或对索拉非尼不耐受的晚期HCC患者对阿西替尼与最佳支持性护理方法进行了比较,两者的OS中位值分别为12.7个月与9.7个月,其差异无统计学显着性。
⑥ Brivanib
Brivanib是以FGFR与VEGFR受体酪氨酸激酶为靶点的选择性双重抑制剂,其中FGF蛋白参与HCC的肿瘤生长与血管生成。Ⅲ期的BRISK-PS试验以先前采用索拉非尼治疗但病情进展或对索拉非尼不耐受的晚期HCC患者为对象,评价了Brivanib与安慰剂了生存效益。结果表明,再者的OS中位值分别为9.4个月与8.2个月(HR?=?0.89;95% CI:0.69~1.15;p?=?0.3307),其差异无统计学显着性。
(2)免疫疗法
在去过的数年内,免疫疗法给肿瘤的治疗带来了巨大的变化,就HCC领域而言,科研人员正在对包括肿瘤抗原疗法、免疫关卡(immune checkpoint)抑制剂与过继性细胞治疗(ACT)在内的多种免疫疗法进行研究,而且已有多个免疫关卡抑制剂获FDA批准用于治疗多种恶性肿瘤。
① 免疫关卡抑制剂
HCC临床试验涉及的免疫关卡抑制剂包括纳武单抗、Pembrolizumab与Tremelimumab等。
一项纳入262名Child-Pugh A级硬化的HCC患者的Ⅰ/Ⅱ期多队列临床试验(checkmate 040)对免疫关卡抑制剂纳武单抗进行了研究,其受试者同时包括了先前未接受过治疗与先前采用索拉非尼治疗但病情进展的受试者。该项试验的剂量爬坡期确证了3mg/kg剂量下的安全性,因此,在随后的试验中,纳武单抗即以3mg/kg的剂量每两周给药一次,而无论患者之前是否接受过治疗,纳武单抗的ORR均在15%~20%之间。69%的应答者在3个月内实现缓解。该项试验还显示,实现18个月OS的受试者在先前未接受过索拉非尼治疗与先前接受过索拉非尼治疗的受试者中所占比例分别为57%与44%,而且是否出现缓解与HCC病因或肿瘤细胞程序性死亡-配体1(PD-L1)的表达情况无关。该项试验中纳武单抗的不良反应特征与先前其他试验的情况相似,主要是转氨酶水平与胆红素水平上升,另有5%的患者因为出现免疫介导的肝炎而需要全身的糖皮质激素治疗。目前,一项Ⅲ期临床试验NCT02576509正在比较纳武单抗与索拉非尼用于晚期HCC一线治疗的有效性与安全性。
一项纳入105名受试者的单组、开放标签的Ⅱ期KEYNOTE-244研究评价了另一种关卡抑制剂Pembrolizumab的有效性与安全性,其ORR值为16.3%(95%CI为9.8~24.9%),一名患者完全缓解。中位PFS为4.8个月,但未到达中位OS值。实现6个月PFS与OS患者所占比例分别为43.1%与77.9%
Tremelimumab也是一种关卡抑制剂,同时还是一种抗细胞毒性T-淋巴细胞相关性蛋白4(CTLA-4)抗体。一项先导性的临床试验(NCT01008358)以伴有HCV感染的HCC患者为对象,对Tremelimumab进行了考察,其疾病控制率为76.4%,疾病进展时间(TTP)为6.5个月。
② PD-L1抑制剂
Atezolizumab是一种PD-L1抑制剂,一项Ⅰb期试验以先前未接受过治疗的不可手术的或转移性HCC患者为对象,对Atezolizumab与贝伐珠单抗的联合用药进行了考察。患者每3周用Atezolizumab 1200mg与贝伐珠单抗15mg/kg注射一次,直至病情出现进展,或出现不可接受的毒性反应。中位随访时间10.3个月后,23名可评价患者的ORR为65%。最常见的治疗相关性3~4级不良反应是高血压。FDA对这一联合疗法用于晚期或转移性HCC一线治疗的适应证认定为突破性疗法。一项Ⅲ期IMbrave150(NCT03434379)正在比较atezolizumab/贝伐珠单抗与索拉非尼一线治疗局部晚期或转移性HCC患者的安全性与有效性。
③ CAR-T
嵌合抗原受体T细胞(CAR-T)属于一种ACT免疫疗法,其在难治性血液系统恶性肿瘤的治疗中已经取得了巨大的成功,其中最令人瞩目的是CAR-T在治疗B细胞急性淋巴性白血病中的应用。肿瘤细胞表面许多表达异常的蛋白/抗原均可用作基因工程T细胞靶向肿瘤细胞的标记物。若CAR-T疗法的适用领域扩展至实体肿瘤,则能极大地改观实体肿瘤的治疗现状,但也面临前诸多挑战,其中,如何精确识别靶点抗原并设计具有高选择性的CARs则是CAR-T疗法临床应用的关键环节。多项研究正在考察CAR-T疗法在HCC与其他实体肿瘤的治疗中的应用前景,甲胎蛋白(AFP)则是能使CAR-T疗法治疗HCC的特异性靶点抗原。AFP是一种分泌型糖蛋白,其通常会在包括儿科肝母细胞瘤与HCC在内的内胚源性肿瘤中均有过度表达的现象,据报道还会促进细胞增殖并抑制细胞凋亡,从而说明其在肿瘤进展中扮演着一定的角色。其他可能与HCC有关的肿瘤相关性抗原(TAA)包括CEA、 MUC1、MAGE-A1、NY-ESO-1、上皮细胞粘附分子(EPCAM)与热休克蛋白70(HSP70)。虽然CART-T疗法的应用前景良好,但也面临着诸多的障碍。其中,CAR-T细胞在肿瘤位点的定位与穿透不充分,以及具有免疫抑制作用的肿瘤微环境导致CAR-T疗法的有效性偏低,此外,由于缺乏肿瘤特异性抗原,CAR-T疗法会引起一系列的靶点外或肿瘤外严重不良反应。潜在的严重的细胞因子释放综合征(CRS)是与CAR-T相关的一种重大毒性反应。CAR-T的特异性可通过双特异性的串联CAR-T予以增强,而其在实体肿瘤中的定位与浸润效果可通过表达趋化因子受体2(CCR2)型等功能性趋势化因子受体而得以增强。此外,采用糖皮质激素与tocilizumab 等单克隆抗体则有助于CRS的治疗。