诺和诺德Victoza获美FDA批准治疗儿科2型糖尿病
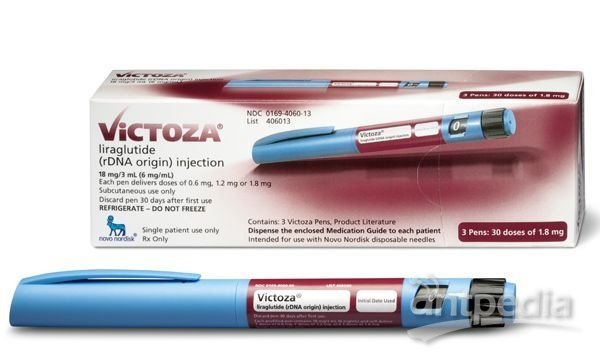
糖尿病巨头诺和诺德(Novo Nordisk)降糖药Victoza(liraglutide,利拉鲁肽)注射液近日获得美国FDA批准,用于10岁及以上2型糖尿病儿科患者的治疗。自2000年二甲双胍被批准儿科用药以来,Victoza是第一个被批准用于治疗2型糖尿病儿科患者的非胰岛素药物。自2010年以来,Victoza已被批准用于2型糖尿病成人患者的治疗。此次儿科适应症通过FDA的优先审查程序获得批准,该批准基于III期临床研究ELLipsE的数据,这是过去10年中在2型糖尿病儿科(10-17岁)群体中完成的首个III期研究,评估了Victoza(1.8mg剂量)相对于安慰剂的疗效和安全性,数据证实了Victoza在降糖方面的优越性。
ELLipsE研究包括一个26周的双盲治疗期,随后是26周的开放标签扩展期。结果表明,当添加至二甲双胍(联用或不联用基础胰岛素治疗)时,与安慰剂相比,Victoza在26周(主要终点)和52周(次要终点)均显著降低了血糖水平(A1c),分别为-0.64%和-0.50%,而安慰剂在26周和52周均使A1c增加,分别为+0.42%和+0.80%。此外,在第26周(次要终点)达到A1c<7%的患者比例,Victoza治疗组(63.7%)高于安慰剂治疗组(36.5%),数据具有统计学显著差异(p<0.001)。
总体而言,Victoza在2型糖尿病儿科患者中的安全性与成人患者中相似。研究中,2组报告不良事件(AE)的患者比例相似(Victoza组为84.8%,安慰剂组为80.9%)。Victoza组(33.3%)的胃肠道不良反应发生率高于安慰剂组(13.2%)。Victoza组发生率≥5%的不良事件包括头痛、鼻咽炎、头晕、胃肠炎、上呼吸道感染、皮疹、发热和食欲下降。接受Victoza治疗的患者中,有24.2%发生轻度低血糖,安慰剂组为10.3%。接受Victoza治疗的患者没有出现严重低血糖症状。
值得注意的是,将Victoza联用胰岛素或其他增加体内胰岛素生成量的药物(如磺酰脲类药物)治疗的成人患者,可能具有增加的低血糖风险。同时,接受Victoza治疗的10岁及以上儿科患者,无论是否接受其他降糖药治疗,均具有较高的低血糖风险。
儿童和青少年群体中2型糖尿病的患病率正在上升,这是由儿童肥胖的全球流行所驱动的,但该类群体的治疗选择有限。Victoza儿科适应症的获批,将为2型糖尿病儿童和青少年患者提供一种重要的新治疗选择。
Victoza(利拉鲁肽)是诺和诺德的一款重磅降糖药,其活性药物成分liraglutide(利拉鲁肽)是一种胰高血糖素样肽-1(GLP-1)受体激动剂,能够刺激天然胰岛素的分泌。在临床研究中,liraglutide不仅能显著改善血糖控制,还能有效减肥并改善肥胖相关合并症。
根据该发现,诺和诺德已将liraglutide开发成了一款减肥针剂Saxenda(liraglutide,3mg)。截至目前,Victoza已获全球100多个国家批准,治疗2型糖尿病患者人数超过120万。
原文出处:FDA approves new treatment for pediatric patients with type 2 diabetes
-
焦点事件
-
焦点事件

-
产品技术

-
焦点事件