Cell亮点丨陈列平团队发现肿瘤免疫逃逸新通路
淋巴细胞活化基因3(Lymphocyte-activation gene 3 ,LAG-3, CD223)是一个在活化T细胞上发现的跨膜蛋白,其蛋白质胞外段有4个免疫球蛋白样结构域 (D1–D4) ,和CD4分子具有较高的同源性【1】。LAG-3主要功能为作为受体传递抑制性信号【2】,负调控CD4和CD8 T细胞的增值、活化、效应功能及其稳态【3】。

LAG-3发挥免疫抑制功能的配体是哪一分子,目前尚存在争议。最初的研究通过细胞与细胞之间的粘附检测表明MHC-II分子和LAG-3之间存在相互作用【4】。某些LAG-3的单克隆阻断抗体,比如C9B7W, 是一种特异性抗小鼠LAG-3 D2结构域的单抗,其并不影响LAG-3与MHC-II的结合,但体内与体外的实验均表明其可以促进T细胞的增值和效应功能【5, 6】。在肿瘤模型中,这种单抗也可以促进肿瘤特异性CD8+T细胞的聚集和效应功能【7】。此外,LAG-3抑制CD8+T细胞和NK细胞的功能也并不依赖与MHC-II分子的相互作用【8】。这些研究表明LAG-3发挥免疫抑制功能,可能是由其他未知配体介导的。
12月21日,耶鲁大学陈列平教授团队(第一作者为王俊博士)在Cell上发表了题为Fibrinogen-like Protein 1 Is a Major Immune Inhibitory Ligand of LAG-3的论文,证明了纤维介素蛋白1(Fibrinogen-like protein 1, FGL1)是LAG-3的一个重要的功能性配体,并揭示了该LAG-3-FGL1通路在肿瘤免疫中的作用。

FGL1属于纤维蛋白原家族,但它并没有特征性的血小板结合位点、凝血酶敏感位点等结构域【9】。在正常生理情况下,肝细胞分泌一定水平的FGL1蛋白,促进肝细胞的有丝分裂及新陈代谢【10】。
本篇研究中,陈列平团队首先利用他们团队的Genome-scale receptor array (GSRA) 技术来筛选LAG-3的结合蛋白(图1)。GSRA是其团队发明的一套半自动基因表达和检测系统,用以快速检测蛋白与蛋白之间的相互作用【11】。该系统以1536孔细胞培养板为载体,分别在293T细胞中过表达人cDNA中的每一种跨膜或分泌蛋白(添加了跨膜结构域)。然后,通过激光扫描和微孔共聚焦荧光识别(the mix-andread laser scanning macro-confocal fluorescent plate reader),来识别已用Ig标记过的目的蛋白与各种跨膜或分泌蛋白的相互作用,从而实现高通量的筛选。现版本的GSRA可以筛选超过6000种蛋白,大约包括90%的人已有注释的跨膜和分泌蛋白。
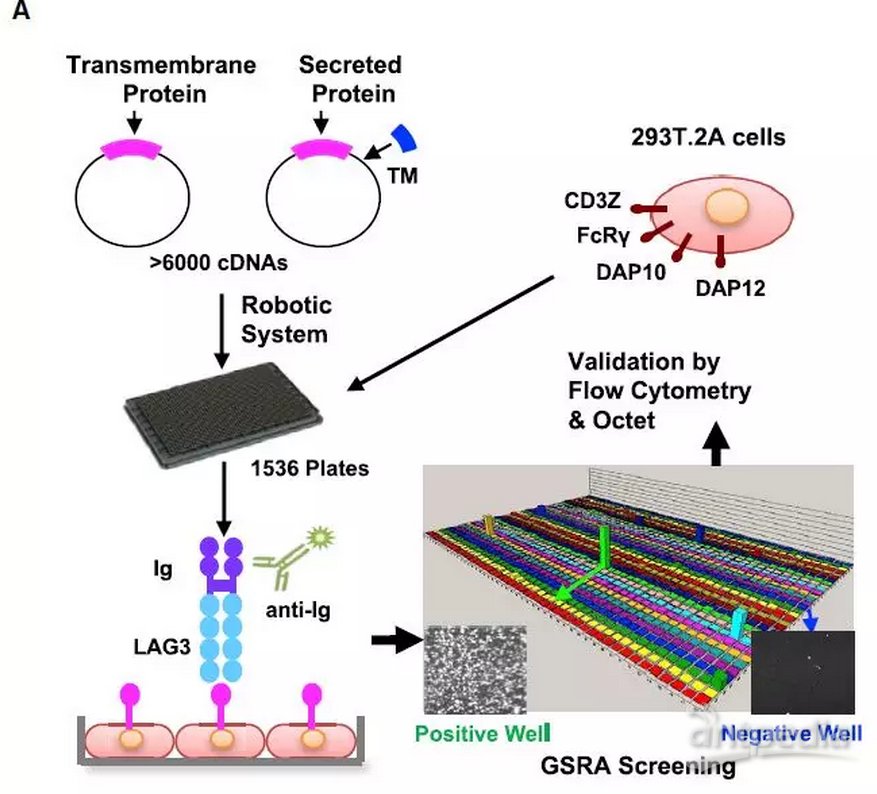
图1 GSRA筛选LAG-3结合蛋白示意图
通过GSRA,研究人员发现FGL1是LAG-3-Ig的一个主要结合蛋白。而且FGL1-LAG-3的相互作用在人和小鼠中都存在。研究人员还用流式以及生化实验进一步证实了两者的结合。随后通过结构域删除实验,他们发现,FGL1和LGA-3的相互作用不依赖于MHC-II分子,FGL1纤维蛋白原样结构域和LAG-3的D1-D2结构域对于两者的结合是至关重要的。再通过一系列的体内与体外实验,他们也证明了FGL1可以通过LAG-3抑制抗原介导的T细胞反应,进一步证实了FGL1是LAG-3的一个功能性配体。
然后,研究者分别在FGL1基因敲除FGL1-KO和LAG-3基因敲除LAG-3-KO小鼠中构建MC38肿瘤模型。结果显示,与野生型WT小鼠相比较,LAG-3-KO小鼠和FGL1-KO小鼠中,肿瘤生长速度都较慢。所有的WT小鼠在实验60天以内达到实验终点(肿瘤平均直径达到15毫米),而50%的LAG-3-KO小鼠和FGL1-KO小鼠在接种肿瘤200天后可以达到无瘤生存。同样地,抗FGL1单克隆抗体和抗LAG-3单克隆抗体,都可以有效地控制小鼠MC38肿瘤模型中肿瘤的生长。相应的,由于缺少T细胞和B细胞,抗FGL1单克隆抗体和抗LAG-3单克隆抗体的抗肿瘤作用在Rag1-KO C57BL/6裸小鼠中完全消失。然后,研究者通过质谱流式细胞仪(CyTOF) 分析了FGL1-KO和WT小鼠肿瘤模型中肿瘤浸润白细胞(tumor-infiltrating leukocytes,TIL)的表型。结果显示,与WT相比,FGL1-KO小鼠肿瘤中CD44+ CD62L-PD-1+ Gata3+ CD4+效应记忆T细胞和CD44+ Ly6C+ CD8+记忆T细胞群的比例明显增加。同时研究人员还发现,和对照组相比较,在抗FGL1单克隆抗体和抗LAG-3单克隆抗体处理的小鼠肿瘤模型中,每微克肿瘤组织中CD45+白细胞、CD8+和CD4+ TIL的绝对数量都有增加。以上表明,在小鼠肿瘤模型中,不论是通过基因敲除还是抗体阻断,阻断FGL1-LAG-3相互作用都可以通过刺激肿瘤微环境中T细胞的活化和增值来提高机体对肿瘤的免疫与清除。
之后,研究人员分析了275份非小细胞肺癌(NSCLC)临床样品中FGL1的表达情况。他们发现FGL1蛋白主要分布于肿瘤细胞中,肿瘤间质表达较低,在正常肺组织没有表达。NSCLC组织中FGL1的表达水平呈连续分布,约15%的样品有较高的表达量,同时高FGL1表达量与明显降低的5年生存率相关。此外,在另一组队列研究中,他们发现与健康人相比,NSCLC病人血浆FGL1水平明显偏高,同时在接受抗PD-1治疗后,血浆中FGL1较高的患者拥有更低的总体生存率。相似的结果也可以在另一组接受抗PD-1治疗的转移性黑色素瘤队列研究中得到。研究人员还在MC38小鼠肿瘤模型中测试了抗FGL1和抗LAG-3在B7-H1-PD-1通路阻抗下的效果,结果表明,单独使用三种抗FGL1单抗,抗LAG-3单抗, 或抗B7-H1单抗处理是可以延缓肿瘤生长和部分延长生存率,抗FGL1单抗或抗LAG-3单抗和抗B7-H1单抗连用是可以明显提高小鼠总体生存率,抑制肿瘤生长。以上表明,FGL1-LAG-3相互作用是独立于B7-H1-PD-1通路的另一条肿瘤免疫逃逸通路,阻断这条通路能和抗PD-1治疗起到协同作用。
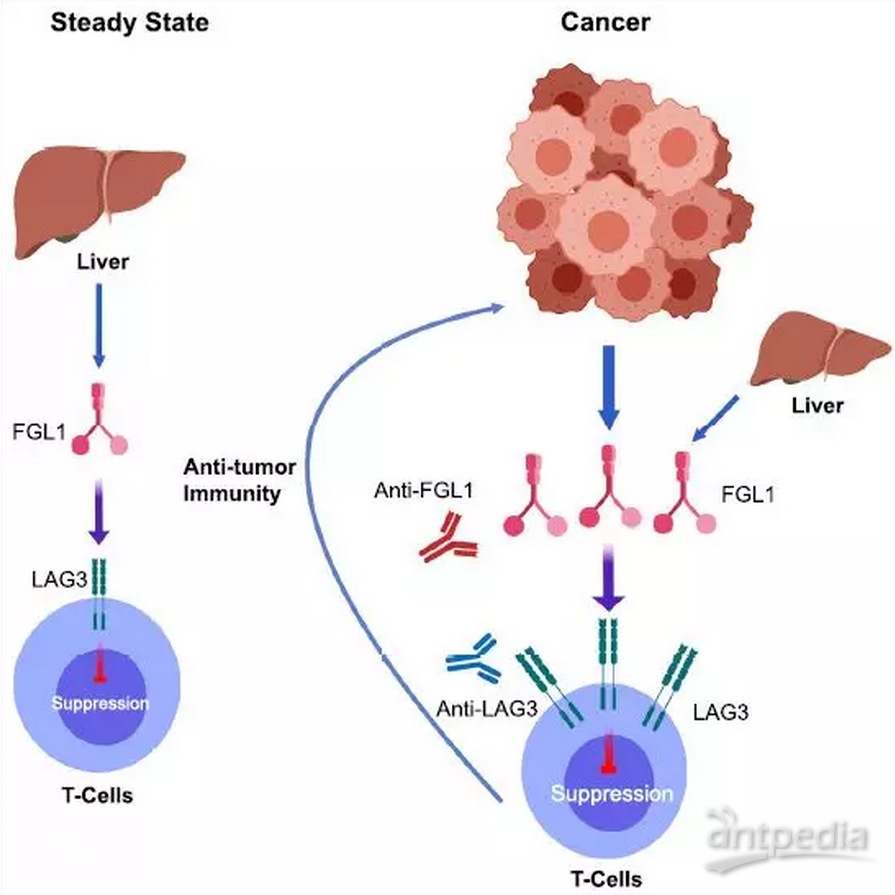
总之,本研究发现并证明了FGL1-LAG-3是肿瘤免疫逃逸的一条新通路,且可作为肿瘤免疫治疗的潜在靶点。

值得一提的是,陈列平教授今年10月份在Cell上发表了一篇题为A Paradigm Shift in Cancer Immunotherapy: From Enhancement to Normalization的重要综述,特别强调了“免疫正常化”的概念最终指导未来肿瘤免疫疗法的设计。
参考文献
1. Triebel, F., et al., LAG-3, a novel lymphocyte activation gene closely related to CD4. J Exp Med, 1990. 171(5): p. 1393-405.
2. Workman, C.J., K.J. Dugger and D.A. Vignali, Cutting edge: molecular analysis of the negative regulatory function of lymphocyte activation gene-3. J Immunol, 2002. 169(10): p. 5392-5.
3. Workman, C.J. and D.A. Vignali, The CD4-related molecule, LAG-3 (CD223), regulates the expansion of activated T cells. Eur J Immunol, 2003. 33(4): p. 970-9.
4. Baixeras, E., et al., Characterization of the lymphocyte activation gene 3-encoded protein. A new ligand for human leukocyte antigen class II antigens. J Exp Med, 1992. 176(2): p. 327-37.
5. Workman, C.J., et al., Lymphocyte activation gene-3 (CD223) regulates the size of the expanding T cell population following antigen activation in vivo. J Immunol, 2004. 172(9): p. 5450-5.
6. Workman, C.J., et al., Phenotypic analysis of the murine CD4-related glycoprotein, CD223 (LAG-3). Eur J Immunol, 2002. 32(8): p. 2255-63.
7. Woo, S.R., et al., Immune inhibitory molecules LAG-3 and PD-1 synergistically regulate T-cell function to promote tumoral immune escape. Cancer Res, 2012. 72(4): p. 917-27.
8. Anderson, A.C., N. Joller and V.K. Kuchroo, Lag-3, Tim-3, and TIGIT: Co-inhibitory Receptors with Specialized Functions in Immune Regulation. Immunity, 2016. 44(5): p. 989-1004.
9. Yamamoto, T., et al., Molecular cloning and initial characterization of a novel fibrinogen-related gene, HFREP-1. Biochem Biophys Res Commun, 1993. 193(2): p. 681-7.
10. Demchev, V., et al., Targeted deletion of fibrinogen like protein 1 reveals a novel role in energy substrate utilization. PLoS One, 2013. 8(3): p. e58084.
11. Yao, S., et al., B7-h2 is a costimulatory ligand for CD28 in human. Immunity, 2011. 34(5): p. 729-40.
-
焦点事件
-
科技前沿

-
焦点事件











