酶促反应动力学
一、酶促反应1913年,Michaelis和Menten根据Henri等提出的酶-底物复合物学说,用简单的快速平衡或准平衡概念推导了单底物的酶促反应方程,即米-曼氏方程(Michaelis-Menten equation)。酶促反应可表示为:
k1 k2 E + S ------------- ES -------- E + P k-1 酶 底物 酶-底物复合物 酶 产物
根据公式进行推导,反应速率(V0或v)与底物浓度[S]、酶浓度[E]和产物浓度[P]的关系如下:

式中Vmax为最大反应速率。这一公式与根据快速平衡学说推导的米-曼氏原始方程形式相同,区别在于用米氏常数Km取代了复合物ES的解离常数Ks,因此仍称为米-曼氏方程。二、Km与Vmax(一)Km 若v=0.5Vmax,则Km=[S],可见Km值等于酶促反应的初速率为最大速率Vmax一半时的底物浓度。Km值一般在10-6~10-2mol/L之间。Km只与酶的性质有关,而与酶的浓度无关。Km是酶的特征性常数之一,在临床酶学分析中有重要意义。1. 1/Km可近似地表示酶对底物的亲和力的大小,Km值越小,表示酶与底物的亲和力越大,反之亦然。2. 如果一个酶有几种底物,则对每一种底物各有一个特定的 Km值,其中Km值最小的底物大都是该酶的最适底物或天然底物。 3.如已知酶的Km,可计算某一底物浓度时反应速率v和最大速率Vmax的比值,并可推知酶的活性中心被底物饱和的分数。同样,如要求v和Vmax有一定的百分比,也可算出所需底物浓度为其Km的多少倍。 4.利用工具酶来测定体液中某一成分的浓度或某一酶的催化活性浓度时,可根据米-曼氏方程或其衍变方程式来计算工具酶的用量。5.测定Km值可鉴别不同来源但催化相同反应的酶是同一种酶或是同工酶。6.如一个酶催化正逆两个方向,测定正逆两个方向底物的Km及底物浓度,可大体推测该酶在体内催化反应的方向及其催化效率。7.在代谢酶系中,当一组酶催化连续的代谢反应时,如已知各酶的Km及其相应底物的浓度,有助于寻找代谢的限速步骤。一般Km值最大的酶所催化的反应为该酶系的限速步骤。(二)VmaxVmax表示在一定酶量下的最大反应速率,即酶完全被底物饱和时的反应速度,与酶浓度呈正比。在酶的浓度不变时,对于特定底物而言,Vmax也是一个常数。如果酶的总浓度已知,可从Vmax计算酶的催化常数,即转换数Kcat。计算公式为Vmax=Kcat[E0]。Kcat表示单位时间内每个酶分子将底物分子转换成产物的最大值。Kcat越大,表示酶的催化效率越高。对于多数酶而言,Kcat在每1 s-1~104 s-1范围内。Kcat/Km比值不仅可用来衡量酶对底物的专一性,还可用于检验酶催化反应是否达到恒态或平衡态。(三)Km和Vmax的测定将米-曼氏方程经过演变而转换成直线方程,然后根据直线的斜率及用外推法或用计算机以最小二乘法处理实验数据即可得到Km和Vmax。其中以Lineweaver-Burk双倒数作图最常用。将米-曼氏方程进行倒数处理,得下列方程:
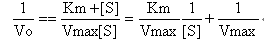
以1/V0为纵坐标,1/[S]为横坐标作图可得一直线。纵轴截距为1/Vmax,斜率为Km/Vmax,横轴截距为-1/Km。Lineweaver-Burk双倒数作图除用于求取Km和Vmax外,还可用于判断可逆性抑制反应的性质。此外还有Woolf作图、Eadie-Hofstee作图和Hanes作图等,实际应用较少。
三、酶促反应的影响因素及反应条件的选择
影响酶促反应的因素主要有酶浓度、底物浓度、pH、温度、电解质及辅酶、激活剂及抑制剂等。(一)酶浓度 在底物浓度远大于酶浓度时,酶促反应随酶浓度的增加而增加,即反应速率与酶的浓度成正比。在病理情况下,酶浓度过高时,底物过早而且过多地被消耗,影响酶活性测定,故需用生理盐水或其他缓冲液进行适当的稀释。但要注意稀释对测定结果的影响,如低酶浓度时,酶易解离为单体,常比多聚体更易失活。 (二)底物的种类和浓度 有些酶专一性不强,可作用多种底物,则须根据需要选择合适的底物。研究酶的生理作用时,一般选择Km最小的最适底物。临床酶学测定时,应首先考虑有较高诊断价值的底物。底物专一性强的酶,如其所催化的为可逆反应,则和专一性不强的酶一样,需要从测定技术和实用方面考虑选择速度较快的正向或负向反应。根据米-曼氏方程,当底物浓度[S]>>Km时,则反应速率v=Vmax=K2[E],即反应速率与酶浓度[E]成正比,此为零级反应。在此种条件下,酶均能与足够的底物进行反应。因此,临床酶学测定时应给予充分的底物浓度。在一定酶量下(Vmax),反应速率视底物浓度[S]而定。当[S]<10值约为1.5~2.5(Q10值为温度增加10℃,化学反应的变化率);而另一方面温度可能使酶失活。一般动物酶的最适温度为35~40℃,植物酶为40~60℃,少数嗜热性细菌所含的酶,其最适温度可达90~100℃。人体大多数酶的最适温度为37℃左右,超过42℃酶活性就逐渐降低,至60℃时酶因蛋白变性而失去活性。反之,酶在20℃以下时几乎无催化反应。酶的最适温度与底物浓度、pH、离子强度、保温时间等许多因素有关。测定酶活性的温度长期未统一,依不同学会推荐大致有3种温度,如25℃,30℃和37℃。我国推荐温度为37℃。近来IFCC也将酶测定温度改为37℃。测定酶活性时,为保证测定结果的准确性,所用温度的误差不能大于±0.1℃。不同温度测定酶活性结果之间,一般不推荐使用酶的温度校正系数(或称温度转换系数)。此外,酶制剂应保存在冰箱中,取出后应恢复至室温立即应用,以免发生变性。(五)激活剂与抑制剂 临床酶学测定中广泛地应用金属离子等激活剂来提高测定的灵敏度。例如所有转磷酸的酶,如激酶类和ALP的反应都需要Mg2+的参加,如在反应体系中加入EDTA等螯合剂或以其为抗凝剂常抑制一些酶的活性。测定CK活性时,加入的激活剂有Mg2+ 和巯基,其中Mg2+是CK的辅基,含巯基的N-乙酰-L-半胱氨酸(NAC)使CK活化。抑制剂所产生的抑制作用分为不可逆性与可逆性两类。前者抑制剂与酶共价结合,使酶活性丧失。此类抑制剂多为非生物源性物质。后者抑制剂通过非共价键与酶可逆性结合。可逆性抑制又分为竞争性、反竞争性、非竞争性抑制和混合性抑制。它们之间的差别在于抑制剂与酶的结合方式不同,从而对酶促反应动力学参数Km和Vmax的影响作用不同(表6-2)。在设计和选择酶测定的方法时,应设法避免抑制剂对酶促反应的影响。如进行尿酶测定时,一般可先通过透析、凝胶色谱或超滤等方法将尿中一些小分子抑制剂与酶分开,以使测定结果更为可靠。 表6-2 各种可逆性抑制与Km及Vmax的关系
| 抑制类型 Km | Vmax |
| 竞争性抑制 增大 反竞争性抑制 减小 非竞争性抑制 不变 混合性抑制 增大或减小 | 不变减小减小减小 |
(六)其他 采用酶偶联法测定酶活性时,反应体系必须加入指示酶,有些方法还需加入辅酶。此外,反应时间及产物对酶促反应也有影响。man'; mso-hansi-font-family: 'Times New Roman'">,少数嗜热性细菌所含的酶,其最适温度可达90~100℃。人体大多数酶的最适温度为37℃左右,超过42℃酶活性就逐渐降低,至60℃时酶因蛋白变性而失去活性。反之,酶在20℃以下时几乎无催化反应。酶的最适温度与底物浓度、pH、离子强度、保温时间等许多因素有关。 测定酶活性的温度长期未统一,依不同学会推荐大致有3种温度,如25℃,30℃和37℃。我国推荐温度为37℃。近来IFCC也将酶测定温度改为37℃。测定酶活性时,为保证测定结果的准确性,所用温度的误差不能大于±0.1℃。不同温度测定酶活性结果之间,一般不推荐使用酶的温度校正系数(或称温度转换系数)。此外,酶制剂应保存在冰箱中,取出后应恢复至室温立即应用,以免发生变性。(五)激活剂与抑制剂 临床酶学测定中广泛地应用金属离子等激活剂来提高测定的灵敏度。例如所有转磷酸的酶,如激酶类和ALP的反应都需要Mg2+的参加,如在反应体系中加入EDTA等螯合剂或以其为抗凝剂常抑制一些酶的活性。测定CK活性时,加入的激活剂有Mg2+ 和巯基,其中Mg2+是CK的辅基,含巯基的N-乙酰-L-半胱氨酸(NAC)使CK活化。抑制剂所产生的抑制作用分为不可逆性与可逆性两类。前者抑制剂与酶共价结合,使酶活性丧失。此类抑制剂多为非生物源性物质。后者抑制剂通过非共价键与酶可逆性结合。可逆性抑制又分为竞争性、反竞争性、非竞争性抑制和混合性抑制。它们之间的差别在于抑制剂与酶的结合方式不同,从而对酶促反应动力学参数Km和Vmax的影响作用不同(表6-2)。在设计和选择酶测定的方法时,应设法避免抑制剂对酶促反应的影响。如进行尿酶测定时,一般可先通过透析、凝胶色谱或超滤等方法将尿中一些小分子抑制剂与酶分开,以使测定结果更为可靠。
表6-2 各种可逆性抑制与Km及Vmax的关系
| 抑制类型 Km | Vmax |
| 竞争性抑制 增大 反竞争性抑制 减小 非竞争性抑制 不变 混合性抑制 增大或减小 | 不变减小减小减小 |
(六)其他 采用酶偶联法测定酶活性时,反应体系必须加入指示酶,有些方法还需加入辅酶。此外,反应时间及产物对酶促反应也有影响。