亮点 | 抗高血脂药物有望用于阿尔茨海默病的治疗
阿尔茨海默病(Alzheimer’s disease, AD),是发生在老年前期与老年期的一种常见的神经退行性脑病,是最常见的老年痴呆类型,其发病率随着年龄增长而显著增加。AD的临床表现为病人渐进性记忆丧失、认知能力下降并伴有焦虑等其他精神相关症状。随着老龄化进程的加剧,全世界的AD患者数量正在急剧增长。我国是世界上最大的老年群体,有着世界最多的AD患者,其护理和治疗将为家庭和社会带来沉重的负担。目前临床上尚缺乏有效的AD治愈方法或药物,因此针对AD的新药靶点探索以及作用于新药靶点的药物一直是近些年来各大医药企业探索的方向。
AD的发病机理非常复杂,受多种因素影响,其中血脂异常是AD的重要风险因素之一。研究显示,β-淀粉样蛋白(β-amyloid,Aβ)的过度产生以及清除不足是诱发AD发病的关键因素【1】。因此,促进大脑中Aβ的清除或是预防和治疗AD的重要策略。PPARA是PPAR家族的一个成员,可通过靶向目的基因启动子区域的PPAR反应元件从而对参与糖脂代谢以及炎症反应的基因进行调控,从而在细胞分化、发育以及新陈代谢(糖、脂、蛋白质)中起关键性的作用【2】。有研究发现,PPARA基因的遗传变异与AD风险相关【3】。自噬是溶酶体介导的一种普遍存在的机体内细胞降解自身细胞器以及功能异常蛋白的过程。大量研究表明,自噬功能障碍在AD的发病机制中起着重要作用【4】,因此诱导自噬的发生有望成为治疗AD的新视角。

近日,中国科学院昆明动物研究所姚永刚课题组在Autophagy杂志上发表了题为Activation of PPARA-mediated autophagy reduces Alzheimer disease-like pathology and cognitive decline in a murine model的研究成果,该研究阐明了核受体过氧化物酶体α(Nuclear receptor peroxisome proliferator-activated receptor alpha,PPARA)激动剂吉非罗齐和匹立尼酸的抗阿尔茨海默病分子机制。
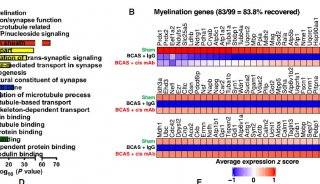
该研究从分子、细胞和小鼠动物模型等多个层次开展了系统的研究。在细胞层面,该研究发现吉非罗齐(gemfibrozil,FDA批准用于治疗高血脂的药物)和匹立尼酸( Wy14643,pirinixic acid)作为PPARA的激动剂,可激活自噬从而对β-淀粉样蛋白进行清除。
在AD小鼠模型层面,吉非罗齐和匹立尼酸能够有效诱导星型胶质细胞和小胶质细胞活化,聚集在Aβ斑块周围,进一步显著增强星型胶质细胞和小胶质细胞对Aβ的吞噬和降解功能,从而改善Aβ病理生理学特征,并且该效应与自噬的发生紧密联系在一起。最终,吉非罗齐和匹立尼酸可显著改善AD小鼠受损的神经元结构与功能,并显著提升AD模型小鼠的学习与记忆能力。该研究不仅进一步支持活化星型胶质细胞和小胶质细胞对Aβ清除的重要性,并且找到了新的靶标PPARA,为FDA批准的治疗高血脂症的药物吉非罗齐进行AD治疗临床试验提供了实验依据。
吉非罗齐和匹立尼酸通过调控PPARA介导的自噬以及胶质细胞功能,从而改善AD相关的病理特征。
总的来说,该研究首次揭示吉非罗齐和匹立尼酸通过激活PPARA介导的自噬在AD中具有重要的保护功能,提出抗高血脂药物或可用于AD治疗的新观点,同时也进一步佐证了小胶质细胞和星型胶质细胞在AD治疗中的核心作用,研究为AD防治开辟了新思路、提供了新靶点。
据悉,中国科学院昆明动物研究所罗荣灿博士与副研究员苏凌燕博士为该论文的共同第一作者,姚永刚研究员为通讯作者。
参考文献1. Wang J, Gu BJ, Masters CL, et al. A systemic view of Alzheimer disease -insights from amyloid-beta metabolism beyond the brain. Nat Rev Neurol. 2017 Sep 29;13(10):612–623.
2. Kersten S. Integrated physiology and systems biology of PPARalpha. Mol Metab. 2014 Jul;3(4):354–371.
3. Kolsch H, Lehmann DJ, Ibrahim-Verbaas CA, et al. Interaction of insulin and PPAR-alpha genes in Alzheimer‘s disease: the Epistasis Project. J Neural Transm (Vienna). 2012 Apr;119 (4):473–479.
4. Harris H, Rubinsztein DC. Control of autophagy as a therapy for neurodegenerative disease. Nat Rev Neurol. 2011 Dec 20;8 840 (2):108–117.
-
焦点事件