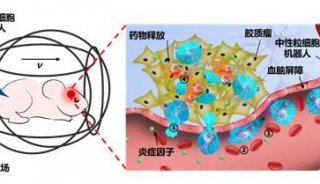
Science丨生长因子调控NADP+合成的新途径
细胞代谢活动受营养物质、外源性生长因子、细胞因子和激素等的影响,从而形成了错综复杂又纷繁多变的信号通路。其中经典的信号通路就有PI3K-Akt-mTOR:生长因子通过刺激雷帕霉素复合物1(rapamycin complex 1,mTORC1)信号网络从而间接调节下游转录因子进而促进合成代谢,而mTORC1信号网络的调控来自PI3K-Akt信号通路【1,2】。由mTORC1信号传导网络调节的关键合成代谢过程(如脂类、脂肪酸和核苷酸的合成等,见下图),需要以NADPH形式提供大量还原能量,NADPH则被氧化成烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adeninedinucleotide phosphate, NADP+),即:NADPH+NAD+→NADH+NADP+ 【3-5】。随后NADP +在如G6PD等脱氢酶的作用下再生为NADPH。生长因子会激活mTORC1信号网络,而Akt又作为中转信号介导mTORC1反应,那么生长因子与Akt之间是否存在必然联系?生长因子又是如何调控细胞中这些还原能量的呢?

PI3K-AKT-mTOR信号通路及下游代谢调控。图片来源A【2】;B:【1】
近日,哈佛T.H.Chan公共卫生学院的Brendan D. Manning在Science上发文Direct stimulation of NADP+ synthesis through Akt-mediated phosphorylation of NAD kinase,发现生长因子通过PI3K-Akt途径诱导NADP+和NADPH的迅速合成。

研究人员首先测定在胰岛素刺激人类胚胎肾293E细胞(HEK293E)中NADP+/NADPH比例的相对变化。发现NADP+/NADPH的比例在胰岛素刺激2小时后均增加,而这些增加被MK-2206(一种高选择性Akt抑制剂)预处理细胞完全阻断(图1,A和B)。利用同位素标记烟酰胺发现,超过75%的细胞烟酰胺被标记,而有~10%和~3%分别标记NAD+和NADP+(图1G)。小干扰RNA(siRNA)介导的细胞溶质NAD激酶(NAD kinase, NADK)活性实验表明该同位素示踪方法对NADK的活性特异性(图1I);在随后的实验中,研究人员进一步发现组成型活性Akt(Akt-CA)而非失活Akt(Akt-KD)的表达增加NADP+合成而不影响NAD+标记(图1J)。这些发现证明Akt诱导NADK催化NAD+→NADP+的合成。

图1.Akt活化刺激NADP+的合成
随后研究人员对NADK进行深入研究,NADK的免疫组化分析显示,在S44、S46或S48单独磷酸化以及S44和S46双重磷酸化的NADK肽在Akt-CA的细胞中富集(图2C)。NADK-S44A突变株丧失了磷酸基序抗体识别NADK(图2D)的能力。NADK突变株的体外Akt酶活测定证明S44和S46是Akt直接磷酸化的主要位点(图2E)。为了确定Akt介导的NADK磷酸化的功能意义,研究人员建立了NADK的突变体[S44AS46A(2A)或S44A-S46A-S48A(3A)],发现野生型NADK和3A突变体表现出相似的酶活性,NADK磷酸化不影响其对NAD +的亲和力,但影响其催化效率(图2F)。这些数据表明,阻断NADK磷酸化不影响其基础酶活性,生长因子诱导的NADP+合成是通过Akt介导的N端保守残基的磷酸化对NADK酶活性的刺激产生的。

图2. NADK是Akt的直接底物,Akt介导的NADK磷酸化刺激NADP+合成
研究人员在mRNA数据库中发现NADK的三种变体(isoform 1, 2, 3):isoform 1, 2含有NADK的N端Akt磷酸化位点,而罕见变体NADK(isoform 3)缺少这个N端磷酸化位点(图3A)。比较isoform 1,isoform 3和缺乏其N-端结构域的isoform 1的突变体的酶活性时发现,isoform 1和isoform 3均显示出增加的酶活性,而对Km没有影响(图3B),缺乏N端调节结构域的isoform 1在响应活化的Akt时NADP +的合成没有增加(图3C)。

图3.NADK的N-末端结构域减弱其催化活性
综上,生长因子激活PI3K-Akt途径,Akt磷酸化NAD激酶(NAD kinase, NADK) N端三个丝氨酸残基(Ser44, Ser46,and Ser48)进而催化NAD+合成NADP+。缺乏该N端保守位点的同种型NADK (isoform 3)则表现出组成型增加的活性。这些证据表明Akt介导的NADK磷酸化通过解除N端自身抑制功能来增强NADP+产生的活性(图4)。

图4. 通过Akt信号传导激活NADK的模型
参考文献
1.Ben-Sahra, I., & Manning, B. D. (2017). mTORC1 signaling and the metabolic control of cell growth. Current opinion in cell biology, 45, 72-82.
2. Manning, B. D., & Toker, A. (2017). AKT/PKB signaling: navigating the network. Cell, 169(3), 381-405.
3. Agledal, L., Niere, M., & Ziegler, M. (2010). The phosphate makes a difference: cellular functions of NADP. Redox Report, 15(1), 2-10.
4. Stanton, R. C. (2012). Glucose‐6‐phosphate dehydrogenase, NADPH, and cell survival. IUBMB life, 64(5), 362-369.
5. DeBerardinis, R. J., & Chandel, N. S. (2016). Fundamentals of cancer metabolism. Science advances, 2(5), e1600200.