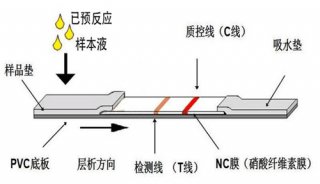
关于免疫层析用微球
“微球粒径怎么选?”
“微球沉淀了怎么办?”
“微球偶联采用两步法进行?”
……
承蒙大家的关照,选择微球作为标记材料来开发免疫层析产品。
今天,小为&小度特意为大家精选了14个在实操过程中,最常见、最具代表性的问题,由于篇幅问题,本次先上7个问答,来看看里面是不是也有你遇到的问题!
Q1:在免疫层析实验中,微球粒径如何选择?
A1:一般情况下,使用的微球粒径在100nm-400nm之间,其中最常用的是200nm和300nm粒径的微球。
Q2:微球中的羧基基团是在微球的内部还是在微球的表面?
A2:有部分基团会被包埋在微球的内部,但是微球是无孔的,我们平时所说的羧基含量是指滴定的微球表面的羧基基团含量,这些基团是可以直接用于共价偶联配体的。
Q3:微球在离心后回收率很低,该如何解决?
A3:一般情况下,微球在离心后丢失最有可能是因为洗涤后随着表面活性剂浓度的降低,微球的疏水性增强从而使其聚集后粘附在管壁两侧,可以增加离心力或者添加表面活性剂来促进微球沉淀。
Q4:在微球沉淀之后,使用超声的方式进行重悬过程中有什么好的建议?
A4:微球的分散可以使用水浴超声的方式进行,这种方式可以有效的使微球分散但又不会使溶液发热,同时选择水浴超声的另一优势是不会像探头插入式超声那样因为使用次数的增多而导至探头污染的可能。
我们没有发现偶联有蛋白的微球超声时会有什么问题,但是需要注意的是如果偶联有蛋白的微球超声时间过长的话也会使偶联的蛋白脱落。
Q5:如何可以知道在微球洗涤过程中没有被污染?
A5:首先应该确保所使用的水是干净无污染的(没有离子、没有有机物、没有微生物等),否则的话微球可以在洗涤过程中吸附水中的杂质。建议使用经0.2um滤膜过滤且无污染的去离子水,同时在洗涤时用显微镜对微球进行检测确认微球处于单分散状态。
Q6:稀释浓度较高的微球,一般使用的稀释液是什么?
A6:一般使用去离子水稀释微球,当然也可以使用某些缓冲液,如偶联抗体前则可以选择偶联缓冲液对微球进行洗涤和稀释。
最后一个问答还没好,小编正在补脑...
Q7:在羧基微球偶联抗体时是推荐一步法还是两步法偶联?
A7:简单的回答是推荐两步法进行偶联。
一步法的缺点是反应溶液的pH值是一个均值,另外最大的缺点是水溶性的碳化二胺既可以结合蛋白同时也可以将所有物质结合在一起,因此很容易使得微球发生团聚,形成的沉淀大小无法控制且分布不均。
两步法包括在低pH条件下使微球和水溶性的碳化二胺反应,羧基形成活化中间体,然后洗涤去除未反应的碳化二胺。需要注意的是羧基活化后的中间体不稳定,容易发生水解,因此洗涤的过程必须快速以减少活化基团的水解。当加入抗体后需要调整溶液的pH值(pH>8)使抗体的氨基基团处于游离状态。在偶联反应完成之后,通过洗涤将未结合的抗体去除干净。虽然两步法的步骤更多了,但可以更好的控制反应的每个过程从而避免微球发生凝集。
如果您仍然想要使用一步法进行偶联反应,那么我们推荐您可以做一些适当的调整:
1. 计算出需要被活化的基团的数量;
2. 加入过量的水溶性碳化二胺将所有基团进行活化,室温下反应时间0.5;
3. 计算出需要偶联到微球上的抗体的数量;
4.加入过量的抗体到已活化的微球中进行反应;这种方法只允许微球和抗体之间发生结合反应,而不允许抗体和抗体之间以及微球和微球之间发生结合反应。
以上问答是我们基于自己的经验所整理,若有不同见解,欢迎交流!