科学家开发出一种有望转化肝癌免疫疗法的新型策略
来自加利福尼亚大学等机构的科学家们通过研究发现,通过串联使用一种被称之为polyIC的合成dsRNA分子来增强肝脏的先天性免疫力,就能使肝癌对一种名为抗PD-L1的免疫检查点抑制剂产生高度反应。
近年来,肿瘤免疫疗法已经成为了一种非常有前途且备受关注的肿瘤学方法,其基于利用称之为免疫检查点抑制剂(ICIs)的人源化抗体来阻断抑制T淋巴细胞活性的细胞通路,T淋巴细胞是一类能帮助保护机体抵御感染及癌症的重要的免疫细胞。最著名的抗体是针对CTLA-4、PD-L1和PD-1的抗体,然而,尽管使用免疫疗法治疗某些恶性肿瘤已经取得了令人鼓舞的成果,但大多数癌症患者对使用ICIs的疗法仍然反应不佳或根本没有反应,最明显的就是肝癌患者。
因此研究人员一直在尝试寻求新方法来改善免疫疗法的治疗效率,尤其是通过结合一种以上的疗法;目前有多种组合性疗法正在进行临床试验,但并没有临床前数据或明确的理由来证明联合疗法的可信度。近日,一篇发表在国际杂志Hepatology上题为“Enhancing the Therapeutic Efficacy of PD-L1 Antibody for Metastasized Liver Cancer by Overcoming Hepatic Immunotolerance”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,通过串联使用一种被称之为polyIC的合成dsRNA分子来增强肝脏的先天性免疫力,就能使肝癌对一种名为抗PD-L1的免疫检查点抑制剂产生高度反应。
研究者Feng说道,在开发肝癌免疫疗法时我们有两个问题必须牢记,一般而言,肿瘤微环境的特点是进行免疫抑制,否则肿瘤就不会生长;另一个复杂的层面则是,肝脏是一个独特的免疫耐受性器官,其会不断暴露于食物中所获取的外来物质中,因此,成功的免疫治疗必须依赖于克服肝脏的免疫耐受并破坏肿瘤微环境中的免疫逃逸机制。为了解决这些问题,研究人员开发了两种小鼠肿瘤模型,其中一种是皮肤下生长肿瘤的模型,另一种则是肝脏内生长肿瘤的模型;这两种类型的肿瘤都来自于相同的结直肠癌细胞系,其能帮助研究人员特异性地调查不同肿瘤微环境所扮演的角色。
研究人员利用抗PD-L1抗体、polyIC分子或二者的组合比较了皮下和肝脏中的肿瘤对相同疗法所产生的反应,结果发现,polyIC或抗PD-L1单药疗法能有效抑制皮下肿瘤的生长,这与此前研究报道的一致,目前并没有任何一种单一的单药疗法能对生长在小鼠肝脏中的肿瘤产生明显的治疗效应。研究者发现,两种制剂的组合或能在肝脏肿瘤抑制方面表现出明显的协同效应,甚至要比皮下肿瘤的作用效果要更好。研究者分析发现,这主要是由于有效提高了肝脏中细胞毒性CD8 T细胞亚群的活性,同时还通过polyIC激活了先天性的免疫细胞,并利用抗PD-L1抗体来阻断T淋巴细胞的抑制性通路。
研究者Feng说道,这种组合所产生的协同效应背后的详细分子和细胞学机制目前我们并不清楚,而让我们感到非常兴奋的原因是,这些研究数据提示了一种可能性,即只要能找到一种克服免疫抑制性肝脏环境的方法,肝癌或许就会变得对免疫疗法产生反应;而且肝癌患者也能从免疫疗法中获益,这或许对于患者而言是非常重要的。
研究者指出,本文研究还提出了关于皮下肿瘤模型进行免疫疗法研究的一个警示,这种模型能被用于进行癌症免疫疗法研究的开创性工作,而且其仍然是癌症免疫学研究中经常使用的动物模型;然而,本文研究结果表明,皮下肿瘤模型在解析独特肝脏肿瘤微环境方面的价值或许非常有限。
综上,本文研究结果表明,肝癌对αPD-L1疗法的治疗反应较差,主要是由于独特的肝脏免疫耐受微环境所致,而与肿瘤起源和类型无关;组合性免疫疗法的成功依赖于机体多种先天性和适应性免疫细胞活性的协调抑制或激活。
-
项目成果
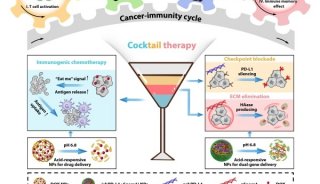
-
招标采购
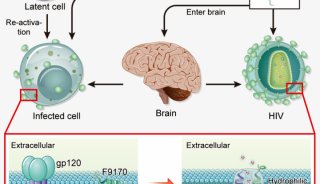
-
项目成果
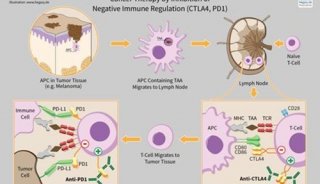
-
项目成果
-
项目成果

-
项目成果

-
科技前沿