前沿显微成像技术专题——超分辨显微成像(2)
上一期我们为大家介绍了几种主要的单分子定位超分辨显微成像技术,还留下了一些问题,比如它的分辨率是由什么决定的?获得的大量图像数据如何进行重构?本期我们就来为大家解答这些问题。
单分子定位超分辨显微成像的分辨率
单分子定位超分辨显微成像的分辨率主要由两个因素决定:定位精度和分子密度。定位精度是目标分子在横向尺寸上的位置,分子密度是样品中目标分子的密度。两者在决定分辨率时同样重要。
定位精度
在单分子定位超分辨显微成像中,单像素通常被放大到100 nm左右,即光学衍射极限(200nm~250nm)的一半, 以满足奈奎斯特双倍采样定律。超分辨成像的终极目标,是要对单分子实现达到10nm的亚像素定位,即在单个像素上能够检测到多个发光点。
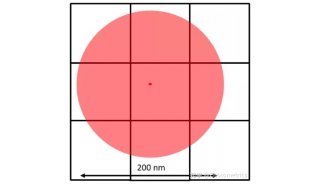
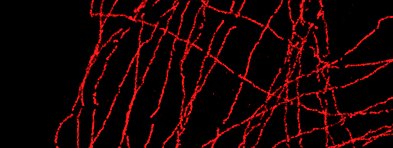
图1 通过高斯拟合的亚像素定位
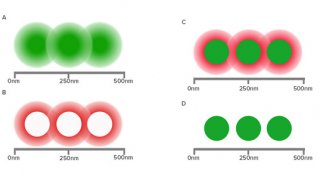
亚像素定位一般是通过高斯拟合实现的。以光学衍射极限250nm为例,这个荧光点能覆盖3x3的100nm像素阵列,如图1。高斯拟合首先通过分析相邻像素的强度,将最亮的像素定为中心像素,也就是发光点应该在的像素位置。如果中心像素左侧像素的强度高于右侧,高斯分布的峰值,也就是发光点必定位于中心像素左侧。同理,如果中心像素上方的像素的强度高于下方,峰值必定位于上方。再结合从四个角的像素获取的信息,就可以精确地确定发光点的峰值位置。
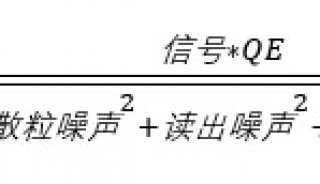
高斯曲线的高度和宽度与检测到信号强度直接相关,信号越强,高斯曲线的峰值越高、形状越细,定位就越准确。因此,提高定位精度最重要的就是增加检测到的光子数。这就是单分子定位超分辨显微成像需要选择高效率的荧光基团和高灵敏度的相机的原因——高量子效率的背照式和大像元的相机能够收集更多的光子。
不过要注意的是,如果相机的像素尺寸大于衍射极限的一半(100nm),高于衍射极限,像素尺寸就会成为定位精度的限制因素,反而会增加定位的不确定性。因此应当在确保满足奈奎斯特采样的前提下,尽量选择大像元的相机。
另外,图像背景会降低图像对比度,也会降低定位精度。背景包括相机噪声、散射光、非特定标记、自发荧光和样品产生的其他噪声源等等。要降低背景,除了在样品制备过程中尽量减少背景荧光外,选用低噪声相机也很重要。
分子密度
如果只是定位精度很高,但是却没有足够多的目标分子来解析样品结构,高定位精度也就失去了意义。根据奈奎斯特定理,两个相邻分子之间的距离应该是所需分辨率的两倍。也就是说,如果要实现20nm的超高分辨率,每10nm就需要有一个目标分子,才能满足采样密度的要求。
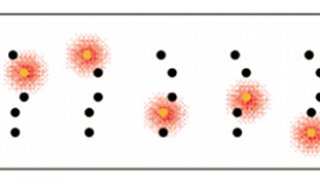
图2 显示了三个定位精度相同,但分子密度不同的模拟样品的成像情况。最右边的样品有足够的分子密度,因此能清楚的呈现出样品边缘位置,而最左边的样品完全不能解析样品边缘的特征。

图2 超分辨率成像中的局部分子密度(From Zeiss Campus)
超分辨显微定位重建算法
在获得了信号强度和分子密度都足够的高质量的原始数据后,还要靠重建算法,对检测到的目标分子进行定位,并重建最终的超高分辨率图像。
一般来说,重建算法需要完成以下7个步骤:
确定每个像素的噪声水平
图像平滑,去除背景荧光
找出每个目标分子的大致位置 (以上第1,2步预处理,就是服务于这个预定位)
对目标分子进行亚像素定位。这是实现超分辨的基础,在每帧图像上定位每一个目标分子的点扩散函数的峰值位置。
克服“密集场”问题,即多个目标分子存在于同一区域,需要单独定位
后处理。通过一系列后处理对数据进行修正,包括去除定位不良的点,合并或删除重复点,校正漂移等
重建完整的超分辨图像
重建算法的设计并非一刀切,许多实验室选择根据不同的实验自行设计不同的重建算法,以更好地匹配不同的荧光基团和样本。即使是同一算法,也需要调整多个参数,才能获得高质量的数据。
重建PALM和STORM的一个最常见的算法就是ThunderSTORM(ovesn_et al.,2014)。它是一个开源的交互式ImageJ插件,强大的功能可以满足对超分辨定位数据进行复杂的分析,自由度高,方便研究人员使用。其他流行的PALM和STORM开源算法,如 RapidSTORM(Wolter et al.,2012) 和 QuickPALM(Henriques et al.,2010) 等,可以提供更高的数据重建速度。
对于DNA-PAINT来说,最流行的算法是Picasso,由Jungmann实验室设计。它与其他重建算法具有相同的功能,也可以用于任何定位显微技术。免费下载地址:https://www.biochem.mpg.de/5608779/Software
现在让我们总结一下,进行单分子定位超分辨显微成像,你需要:
高灵敏度,低噪声的科学相机
高效率的荧光探针,适当(和定位精度相匹配)的标记密度
合适的重建算法
Teledyne Photometrics 的 Prime 系列背照式sCMOS相机(Prime 95B,Prime BSI)具有sCMOS相机的最高灵敏度,是单分子荧光和超分辨成像应用的理想选择。它们还可配备PrimeEnhance™和PrimeLocate™智能 FPGA 图像处理功能,可以提高超分辨成像的定位精度,帮助您轻松处理海量数据。
PrimeEnhance
我们都知道单分子荧光信号在理想状态下是一个光点。然而,实际成像过程中噪声这个如影随形的幽灵会对定位精度产生很大的影响。通过适当的降噪算法,可以在样品和成像条件不变的情况下,显著提高图像信噪比,达到提供定位精度的目的。
通过算法降低噪声听起来容易,事实上存在许多挑战,如何保留数据的定量性,以及样品的关键特征,如对比度较低的边缘、纹理和细节等都是需要考虑的问题。除此以外,还必须保证降噪算法不会产生新的伪影,并能适用于不同类型的图像。另一方面,由于散粒噪声随信号的变化而变化,许多降噪算法很难区分信号和噪声,导致样品中小的细节被去除。

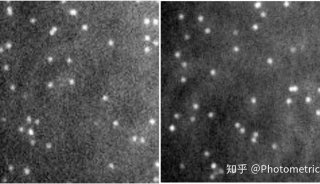
我们隆重向您介绍PrimeEnhance功能,它能够在将图像信噪比提高3-5倍的同时,保留样本的细节和特征,适用于不同类型的图像,并不引入伪影。更关键的是,它能确保处理后的图像信号强度保持不变,从而不影响定量计算。从图3a和3b的对比我们可以很明显的看到,PrimeEnhance功能打开之后,信号强度不变,图像信噪比显著提高,还能呈现出之前分辨不了的样品细节特征,简直神器!您只需要在相机参数设置里打开PrimeEnhance功能,就可以获得想要的高信噪比图像啦!
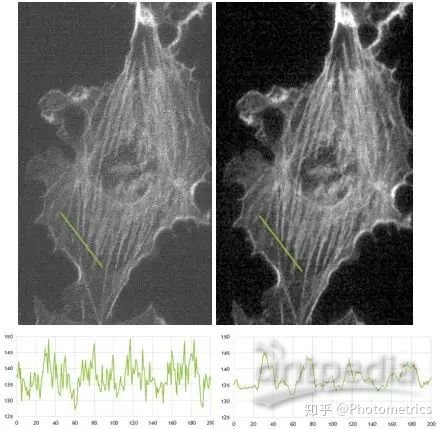
图3 开启PrimeEnhance功能之前 (左) 和之后(右)图像对比,下方为两张图中绿线对应的线强度曲线。
PrimeLocate
超分辨定位显微成像要求单张图像中,目标分子整体分布稀疏,以分辨出单个荧光分子。所以我们拍到的单张图像大部分都是背景。如果能够通过预处理将背景从图像中删除,获取的数据量和数据处理所需的时间都会大大减少。
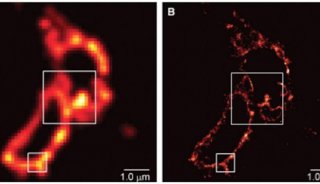
PrimeLocate 功能就是帮您去掉这些无用又占地方的背景的。它可以识别图像中的单个分子,并仅将这些区域保存下来(图4)。如果我们比较数据压缩能力,不使用PrimeLocate,压缩比约45%;使用 PrimeLocate,压缩比可以增加到约85%。显著减少所需的存储空间,解放硬盘的同时还能让您的 sCMOS 相机以更快的速度工作。

图4 PrimeLocate能动态识别图像中的单个分子(a),去除区域周围的背景,仅传输单个分子的信息(b)
正所谓工欲善其事,必先利其器。想要得到高质量的图片进行超分辨定位,相机的选择是至关重要的!在下一期中,我们将对背照式 sCMOS 和 EMCCD 的成像效果进行直观比较,看看谁才是这一领域的王者。敬请期待~
References
Henriques, R., Lelek, M., Fornasiero, E. F., Valtorta, F., Zimmer, C. & Mhlanga, M. M. (2010) QuickPALM: 3D real-time photoactivation nanoscopy image processing in ImageJ. Nat Methods. May;7(5):339-40. doi: 10.1038/nmeth0510-339.
Jungmann, R., Avendaño, M. S., Woehrstein, J. B., Dai, M., Shih, W. M. & Yin, P. (2014) Multiplexed 3D cellular superresolution imaging with DNA-PAINT and Exchange-PAINT. Nat Methods. Mar; 11(3): 313–318. doi: 10.1038/nmeth.2835
Ovesný, M., Křížek, P., Borkovec, J., Svindrych, Z. & Hagen, G. M. (2014) ThunderSTORM: a comprehensive ImageJ plugin for PALM and STORM data analysis and super-resolution imaging. Bioinformatics. Aug 15;30(16):2389-90.
Wolter, S., Löschberger, A., Holm, T., Aufmkolk, S., Dabauvalle, M. C., van de Linde, S. & Sauer M. 2012. rapidSTORM: accurate, fast open-source software for localization microscopy. Nat Methods. Nov;9(11):1040-1.